
Dalla metà degli anni '80, quando fu scoperto l'HIV e si dimostrò il nesso causale con l'AIDS, la ricerca per sviluppare un vaccino non si è mai arrestata. Ma nonostante l’impegno della comunità scientifica e una quantità ingente di ininterrotti finanziamenti, vi sono stati solo fallimenti (con un’unica, parziale eccezione): ora, però, la scoperta che una frazione di individui infettati produce anticorpi neutralizzanti ad ampio spettro ha portato allo sviluppo di nuovi vaccini sperimentali, attualmente in fase di sperimentazione clinica, con strategie innovative come il Germline Targeting.
Crediti immagine: Immagine di freepik
Nel suo libro autobiografico appena uscito, On call. A doctor’s journey in public health, Anthony S. Fauci, per 38 anni a capo del National Institute for Allergy and Infectious Diseases di Bethesda, USA, si dichiara scettico sulla possibilità di scoprire un vaccino per prevenire l’infezione dell'HIV, causa della sindrome da immunodeficienza acquisita (AIDS), letale al 95% in assenza di terapia. Tuttavia, la necessità di un vaccino anti-HIV, soprattutto nei paesi più poveri con scarso accesso alla terapia antiretrovirale di combinazione (cART), rimane intatta.
Dopo un periodo caratterizzato solo dai fallimenti delle ultime sperimentazioni cliniche di fase III, un “pacchetto” di pubblicazioni uscite quasi contemporaneamente sulle principali riviste scientifiche rimette in gioco la possibilità di raggiungere questo Sacro Graal vaccinale. Ma riavvolgiamo il nastro prima di entrare nel merito.
Dopo la scoperta del virus nel 1983 per merito degli scienziati dell’Istituto Pasteur di Parigi, insigniti del Premio Nobel per la medicina o la fisiologia nel 2008, e la dimostrazione del nesso di causalità con l’AIDS nel 1984 (per merito del team USA guidato da Robert C. Gallo, non incluso nel Premio), è immediatamente scattata la ricerca di un vaccino: se ne prevedeva la scoperta «in un paio d’anni», come dichiarò Margaret Heckler, segretaria del Department of Health and Human Services statunitense. Mai previsione fu più sbagliata! Nonostante l’impegno della comunità scientifica e una quantità ingente di ininterrotti finanziamenti, la storia della ricerca di un vaccino ha collezionato solo fallimenti, con un’unica, parziale eccezione: lo studio RV144 condotto in Thailandia, che ha dimostrato una protezione di circa il 30% dei vaccinati rispetto ai controlli nei primi 3 anni d’infezione, come già discusso su Scienza in rete. Purtroppo, il risultato non è stato confermato da studi clinici successivi che, però, hanno modificato molti parametri rispetto a RV144 collezionando solo fallimenti.
Ma perché non è stato ancora possibile, fatta la parziale eccezione di cui sopra, ottenere un vaccino anche solo parzialmente efficace? Riassumiamo, sinteticamente, i motivi principali:
- Non esiste eliminazione spontanea del virus da una persona infettata. Al nostro sistema immunitario manca quindi “il codice” di eliminazione del retrovirus, perché si integra nel genoma di linfociti T e macrofagi, garantendosi la persistenza “a vita”;
- Il virus è caratterizzato da un’altissima variabilità spontanea. Il suo enzima chiave, la trascrittasi inversa (che copia il genoma virale a RNA in una versione a DNA in grado d’integrarsi nel genoma della cellula infettata) non è dotato della funzione di “correzione delle bozze”, presente in molti virus, inclusi i coronavirus della SARS e di COVID-19;
- Gli anticorpi neutralizzanti (neutralizing antibodies, nAb) in grado di prevenire l’infezione si generano solo dopo diversi mesi dal contagio. La prima risposta anticorpale è infatti diretta contro lo scudo zuccherino che protegge la glicoproteina gp120 Env (la “chiave” utilizzata dal virus per legarsi al recettore primario d’ingresso, la molecola CD4, e il co-recettore chemochinico CCR5 o CXCR4), mentre i linfociti T specifici sono in grado di controllare la quantità di cellule infettate, ma non di eliminarle completamente (principalmente perché alcune cellule infettate albergano il virus integrato e latente, quindi “invisibile” al riconoscimento immunitario). Per inciso, nel caso dello studio RV144, la risposta immunitaria (parzialmente) protettiva non è risultata convenzionale, ma associata alla secrezione di anticorpi non neutralizzanti.
In questo scenario sconfortante, però, si è accesa una luce. La ricerca scientifica è un continuum, per cui spesso è molto difficile definire quale sia il momento in cui inizia una nuova fase in un determinato ambito di ricerca. Nella lunga storia della ricerca di un vaccino anti-HIV, un punto di svolta scientifico, alla base degli studi in oggetto, è stato aver dimostrato che una frazione non piccola (il 10% circa) degli individui infettati produce, seppur tardivamente, anticorpi neutralizzanti ad ampio spettro (broadly neutralizing Ab, bnAbs) dotati spesso di una straordinaria efficacia; infatti, alcuni sono oggi utilizzati come farmaci complementari o alternativi ai classici farmaci antiretrovirali.
Carpire il segreto di questi anticorpi neutralizzanti ad ampio spettro, ovvero decifrarne le porzioni di antigene (epitopi) riconosciuti, è stata la base per la scoperta di nuovi vaccini sperimentali. Quasi tutti i bnAbs riconoscono un trimero di gp120 Env alla superficie della particella virale (virione). I primi anticorpi prodotti, non sempre neutralizzanti, causano una selezione della popolazione virale la quale, a sua volta, induce i linfociti B specifici a produrre anticorpi neutralizzanti a sempre maggior affinità per l’antigene riconosciuto. Riuscire a incrementare l’affinità per l’antigene fino a 10.000 volte rispetto ai primi anticorpi prodotti è una proprietà esclusiva dei linfociti B, mediata da enzimi della famiglia AID (Activation-Induced cytidine Deaminase) che inducono ipermutazioni somatiche nell'estremità degli anticorpi nei siti di riconoscimento dell’antigene, definiti CDR (Complementarity Determining Regions) (Figura 1).
La nuova strategia utilizzata è stata definita Germline Targeting, perché ha l'obiettivo di stimolare linfociti B vergini (naive) in grado di produrre anticorpi precursori dei bnAbs desiderati. Alcuni gruppi di ricerca l’hanno adottata contro epitopi di una regione variabile della glicoproteina gp120 Env detta V3-N332, la cui funzione neutralizzante è legata all’interazione con uno zucchero (glicano), mentre altri si sono concentrati nella produzione di bnAbs appartenenti alla famiglia del VRC01, il bNAb capostipite, contro un sito di legame di gp120 Env alla molecola CD4, come riassunto e discusso in un editoriale su Science.
Entrambi i tipi di bnAbs sono stati isolati da diversi individui infettati, a dimostrazione che la loro generazione non è un evento sporadico o casuale; vaccini sperimentali che mirano alla produzione di bnAbs sia contro V3-N332 sia contro il sito di legame al CD4 sono già in fase I di sperimentazione clinica. Inoltre, questi studi su modelli animali hanno suggerito la necessità di una strategia sequenziale per indurre questi bnAbs in seguito a vaccinazione. Un primo immunogeno dovrebbe stimolare i linfociti B vergini a produrre i primi anticorpi, un secondo dovrebbe favorire la selezione di linfociti B memoria e un terzo immunogeno dovrebbe completare la maturazione d’affinità del/degli Ab desiderato/i. Tutti questi processi avvengono in base al principio darwiniano della selezione del più adatto, ovvero dei linfociti B in grado di produrre gli anticorpi a maggiore affinità per l’antigene.
Tuttavia, altri studi hanno dimostrato che l’induzione di bnAbs potrebbe essere meno complessa almeno per un bersaglio diverso da quelli discussi: la porzione di gp41 (l’altra molecola del mantello virale che media la fusione della membrana virale con quella della cellula bersaglio) nota come MPER (Membrane Proximal External Region), meno variabile di altre regioni della molecola, ma difficilmente accessibile al riconoscimento anticorpale.
Uno studio di fase I (HVTN 133) condotto su 24 volontari sani, inclusi 4 controlli che hanno ricevuto un placebo, cui sono state somministrate diverse dosi di un vaccino sperimentale basato su liposomi caricati col peptide desiderato, ha dimostrato che già dopo solo due immunizzazioni si ottiene l’induzione ottimale di secrezione di bnAbs associata alla presenza di linfociti T CD4 specifici (i “direttori d’orchestra” della risposta immunitaria) (Figura 2). Con lo stesso obiettivo, diversi gruppi di ricerca hanno disegnato una batteria di immunogeni esponenti il sito MPER, definiti 10E8-GT. Sebbene i primi anticorpi germinali inizialmente non fossero in grado di legarsi a MPER, il processo di maturazione per affinità conseguente alle ipermutazioni somatiche ha progressivamente selezionato anticorpi che, alla fine, erano in grado di neutralizzare la maggior parte dei ceppi di HIV-1, almeno in vitro.
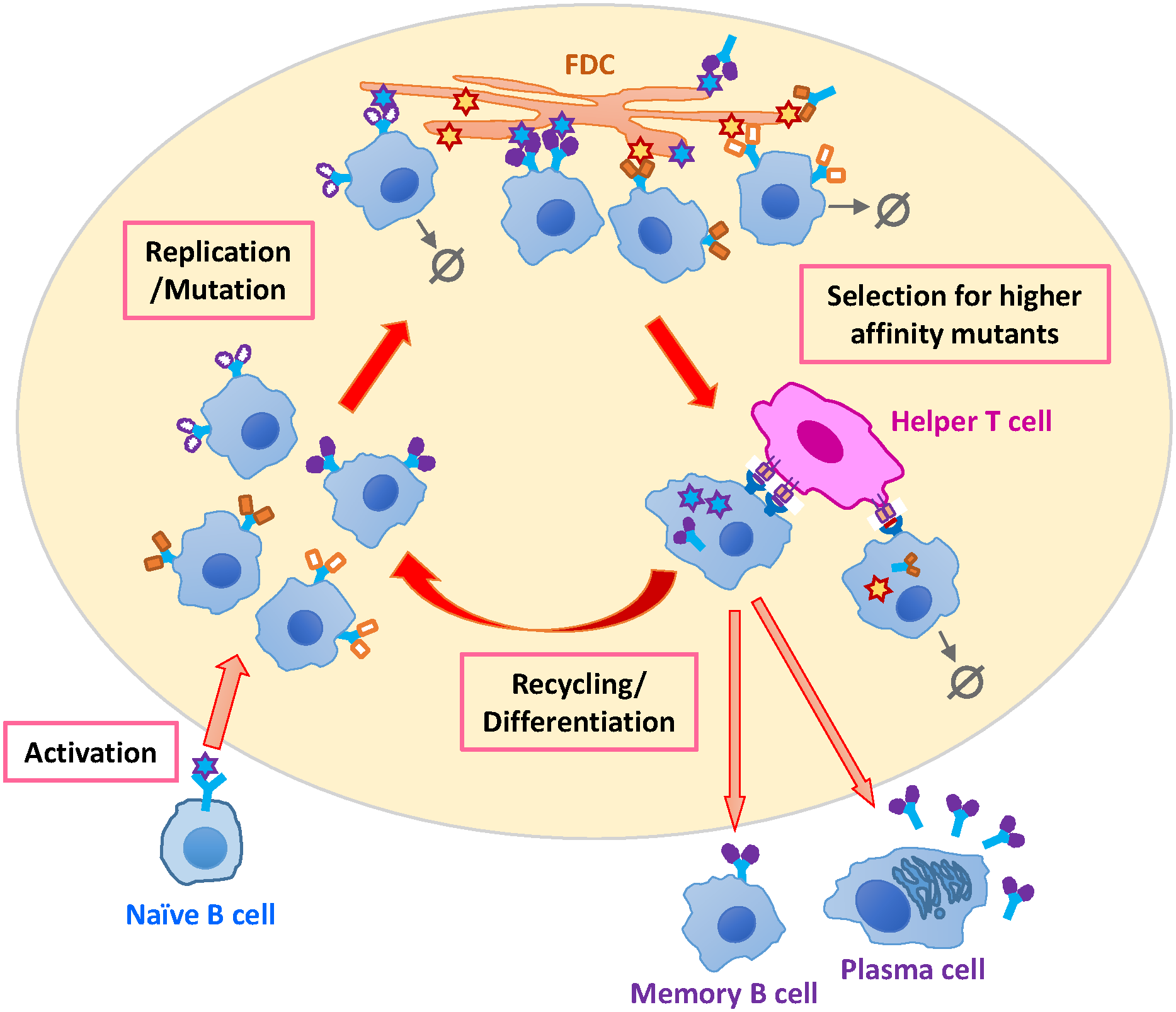

Figura 1. Maturazione dell'affinità dei linfociti B. Crediti immagine: Wang S et al. (2017) Optimal Sequential Immunization Can Focus Antibody Responses against Diversity Loss and Distraction. PLoS Comput Biol Licenza: Attribution International 4.0
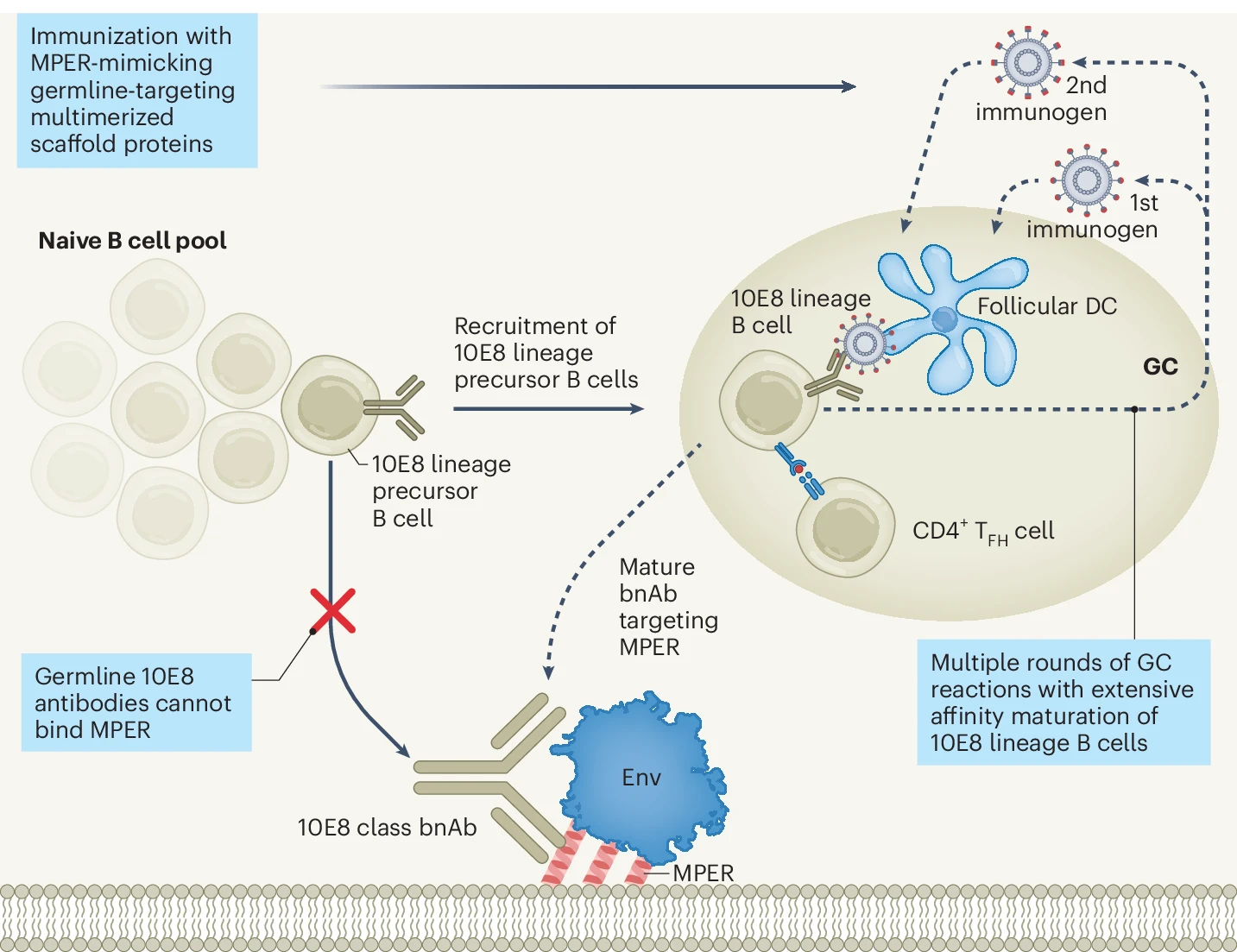
Figura 2. Strategia vaccinale per indurre bnAbs diretti contro la regione MPER di gp41 Env. La regione MPER contiene la cardiolipina della cellula ospite riconosciuta dai bnAb anti-gp41 Env (da Williams et al. Vaccine induction of heterologous HIV-1.neutralizing antibody B cell lineages in humans, Cell, 2024. Licenza: Attribution International 4.0)
Sebbene questi studi ridiano forza alla speranza d’identificare finalmente un vaccino anti-HIV, ci sono tuttavia note prudenziali sempre importanti da tener presente. La prima, in riferimento alla strategia sequenziale, è l’estrapolazione di risultati ottenuti in modelli animali, per cui è impossibile predire la potenza, ovvero la quantità di bnAbs generabili nell’essere umano in base a questo approccio, sebbene alcuni studi nel macaco siano incoraggianti. Una seconda incognita è relativa alla durata dell’effetto neutralizzante/protettivo rispetto all’infezione legato all’induzione di un numero sufficiente di plasmacellule a lunga vita (le plasmacellule, vere e proprie “mini fabbriche” cellulari di produzione degli anticorpi, rappresentano, assieme ai linfociti memoria, una delle possibili evoluzioni dei linfociti B indotte dalla stimolazione antigenica). Infine, una volta raggiunta la proof of concept, sarà importante implementare una strategia vaccinale sufficientemente semplice ed esportabile che non preveda troppi richiami per essere efficace.
In conclusione, come sempre nella scienza, è bene sottolineare che i progressi nella ricerca di un vaccino anti-HIV beneficeranno sicuramente anche lo sviluppo di altri vaccini contro importanti malattie infettive non ancora debellate, dall’influenza a SARS-COV-2.


