Crediti immagine: fernando zhiminaicela/Pixabay. Licenza: Pixabay License
Sono passati ormai cinque mesi da quando il SARS-CoV-2 è stato per la prima volta identificato nel dicembre 2019 in Cina. Uno degli sforzi della comunità scientifica è stato quello di identificare un test diagnostico sensibile e specifico da utilizzare sia in fase di screening nei soggetti asintomatici, sia nei pazienti sintomatici sia durante la convalescenza con lo scopo di identificare i pazienti guariti e potenzialmente immuni (1).
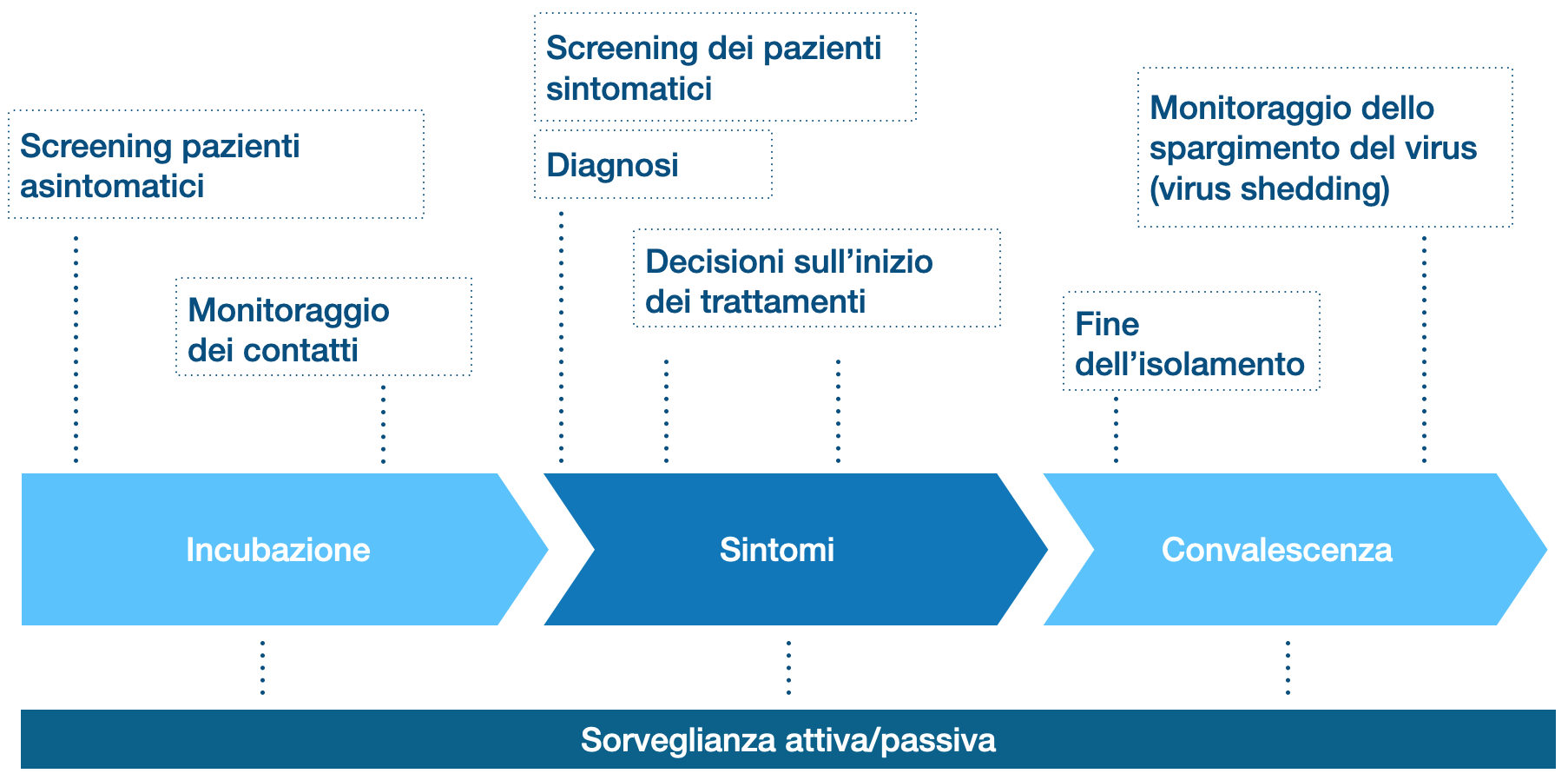
Figura 1. Uso dei test Covid nelle varie fasi.
Le raccomandazioni dell’OMS indicano, nei soggetti sospetti, di raccogliere un tampone delle alte vie aeree (nasofaringeo/orofaringeo) al fine di eseguire la ricerca del SARS-CoV-2 tramite metodica RT-PCR. Il tampone orofaringeo o nasale consiste nel prelievo delle cellule superficiali della mucosa del faringe posteriore o del rinofaringe, mediante un piccolo bastoncino ovattato, simile a un cotton fioc, ma in materiale sintetico, capace di trattenere molto più materiale organico rispetto all’ovatta. Il prelievo è rapido e appena fastidioso: deve essere eseguito da personale, dotato di DPI, addestrato a evitare sia il contatto del tampone con la lingua, le guance o le arcate dentarie per non contaminare il campione con la saliva, in caso di raccolta orofaringea, sia una raccolta scorretta del tratto più esterno delle fosse nasali, in caso di raccolta nasale (2).
Dal materiale biologico viene effettuata la ricerca dell’RNA virale utilizzando una metodica molecolare rapida molto specifica, chiamata Reverse Real-Time PCR (rRT-PCR) che, mediante il processo di retrotrascrizione, permette la sintesi di una molecola di DNA a doppio filamento a partire da uno stampo di RNA, a cui segue una amplificazione per PCR nella stessa provetta di reazione (qui maggiori informazioni dall'OMS).
Tuttavia, l’eventuale negatività del tampone non esclude la diagnosi in caso di forte sospetto clinico, in cui vi è indicazione a raccogliere un campione delle basse vie aeree tramite lavaggio bronchiolo-alveolare (BAL) o aspirato endotracheale; per minimizzare la generazione di aerosol potenzialmente infetto, non è consigliato il prelievo da espettorato indotto. Inoltre, data la non rara (tra il 6-60%) co-infezione con altri virus respiratori quali influenza A e B, virus respiratorio sinciziale, enterovirus, adenovirus, coronavirus umani endemici o la possibile sovra-infezione batterica, il riscontro di un agente patogeno diverso dal SARS-CoV2 non esclude la COVID-19.
Infine, nei pazienti ospedalizzati, l’OMS raccomanda l’esecuzione di tamponi seriati (ripetuti con regolarità), in modo da monitorare l'eliminazione (clearance) del virus e di subordinare le dimissioni dei pazienti clinicamente guariti al riscontro di almeno 2 tamponi negativi a distanza di 24 ore (3).
Accuratezza diagnostica
Attualmente, i valori di sensibilità raggiunti dai vari test RT-PCR per SARS–CoV2 si attestano tra il 45 e il 60%; ne consegue un numero considerevole di risultati falsi negativi. Verosimilmente, i limiti diagnostici del tampone prelevato dalle alte vie aeree derivano da diversi fattori tra cui:
- utilizzo di 7 kit differenti la cui accuratezza diagnostica non è omogenea
- momento di esecuzione del tampone: la carica virale raggiunge il suo picco nelle alte vie aeree dopo 3 giorni dall’inizio dei sintomi
- maggiore carica virale nel campione nasofaringeo rispetto al campione orofaringeo
- metodica di raccolta del campione, che dipende dall'operatore
È importante sottolineare, come sottolineato in un lavoro pubblicato su Nature, che la positività della RT-PCR indica solo la presenza dell’RNA e non necessariamente del virus vitale (4).
Nasofaringeo vs orofaringeo
In uno studio cinese condotto su 353 pazienti è stata comparata l’accuratezza diagnostica del tampone nasofaringeo rispetto a quello orofaringeo. I risultati hanno dimostrato che il 73,1% di pazienti positivi al tampone nasofaringeo presentava un tampone orofaringeo negativo a dimostrazione di come possa essere elevato il numero di falsi negativi utilizzando esclusivamente un campione prelevato dall’orofaringe (5).
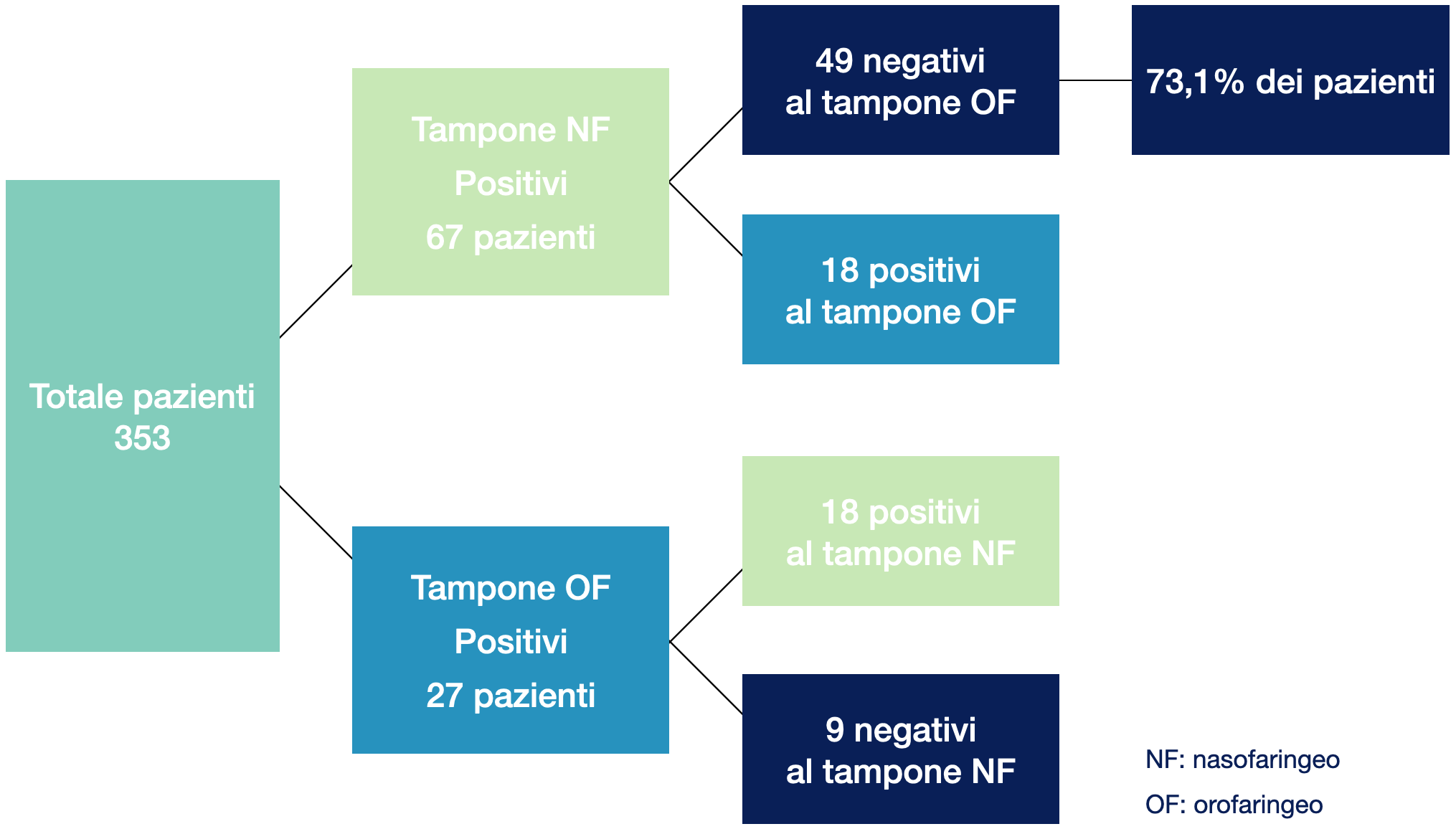
Figura 2.
Perché un tampone non basta
L’accuratezza diagnostica del test può aumentare con una raccolta ripetuta dei tamponi. In uno studio condotto su 51 pazienti affetti da COVID-19, la sensibilità del primo tampone respiratorio era del 70%; tale valore raggiungeva il 94% e il 98% con l’esecuzione del secondo e del terzo tampone.
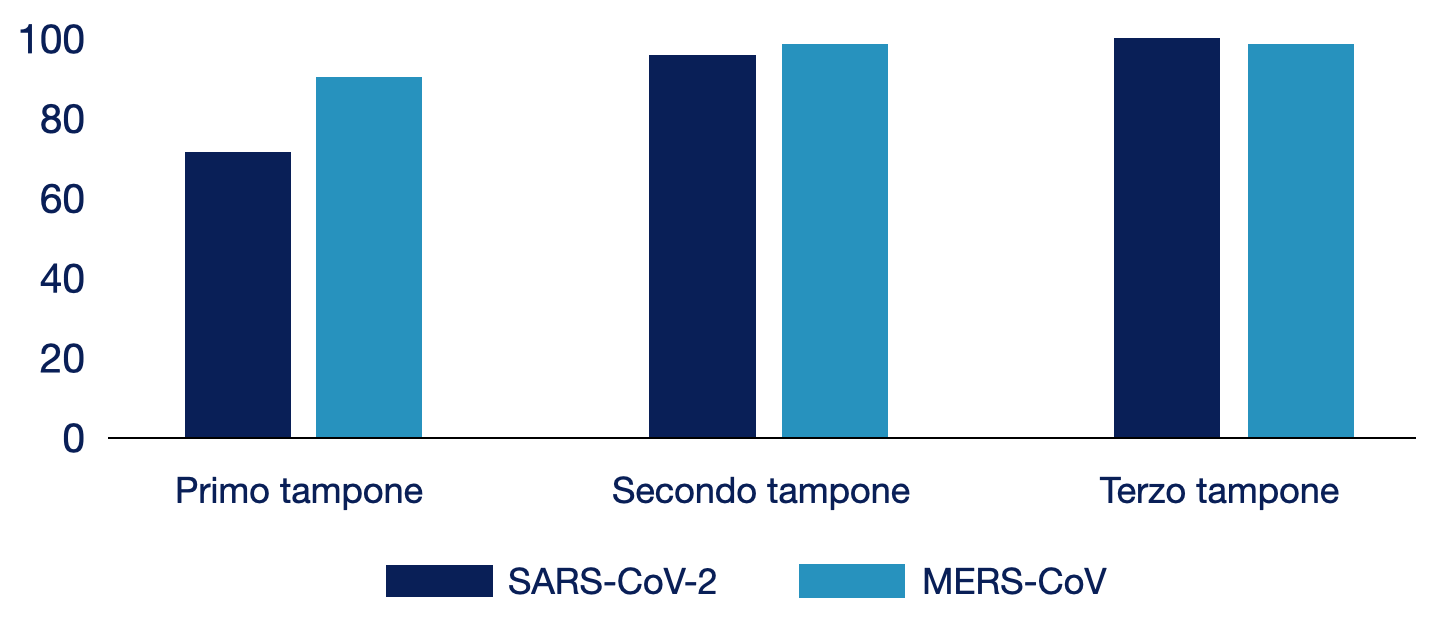
Figura 4.
La TC vede più del tampone
Interessanti sono, inoltre, i dati di sensibilità della RT-PCR su tampone rispetto a quella della TC del torace: un grande studio cinese condotto a Wuhan ha documentato che, nella stessa coorte di 1.014 pazienti, solo il 59% era risultato positivo al tampone delle alte vie aeree, mentre l’88% presentava una TC torace alterata. Inoltre, il 75% dei pazienti con tampone negativo aveva una TC torace suggestiva di interessamento polmonare (6).
Dall’analisi congiunta della raccolta seriata dei tamponi e dell’esecuzione di TC torace è derivato che una percentuale tra il 60 e il 93% dei pazienti presentava una TC torace già suggestiva per polmonite virale prima ancora della positivizzazione della RT-PCR (7) .
Tamponi e altri test su campioni biologici diversi
Con lo scopo di individuare un test biologico che raggiungesse un buon compromesso tra sensibilità e specificità, diversi studi sono stati eseguiti testando la RT-PCR su campioni biologici diversi. Interessante a tal proposito è un lavoro pubblicato a marzo su JAMA, che analizza la sensibilità dei tamponi e altri test su sangue, espettorato, feci, urine, mucosa nasale, lavaggio bronchiolo-alveolare (BAL) e brushing bronchiale di 205 pazienti (8). In figura sono riportati i risultati, che confermano la maggiore sensibilità del tampone nasale rispetto a quello faringeo.
| Campione biologico | N. pazienti | Positivi |
|---|---|---|
| BAL | 15 | 93% (14) |
| Brushing bronchiale | 13 | 46% (6) |
| Espettorato | 104 | 72% (75) |
| Tampone nasale | 8 | 63% (5) |
| Tampone faringeo | 389 | 32% (126) |
| Feci | 153 | 29% (44) |
| Sangue | 307 | 1% (3) |
| Urine | 72 | 0% (0) |
Tabella 1.
Un altro punto da sottolineare è che le percentuali di positivi dei campioni nasale e fecale sono sovrapponibili; ciò a conferma di quanto già dimostrato sul tropismo del SARS-CoV-2 per la mucosa gastrointestinale e sulla possibile trasmissione oro-fecale dell’infezione anche in assenza di sintomi gastroenterici.
Tampone fecale, a cosa serve
Due studi condotti nella provincia di Hubei hanno analizzato il possibile ruolo della RT-PCR su tampone fecale per la diagnosi e il follow-up di Covid-19. Nel primo (9) sono stati valutati 42 pazienti di cui solo il 19,05% presentava sintomi gastrointestinali. Sul totale dei pazienti, il 66,67% è risultato positivo alla ricerca di SARS-CoV-2 RNA nelle feci in assenza di sintomi gastrointestinali. Tra questi, nel 64,29% dei pazienti, il tampone fecale è rimasto positivo per circa 7 giorni dopo la negativizzazione del tampone faringeo. Inoltre, è stato dimostrato che, dall’insorgenza dei sintomi, il tempo medio di positivizzazione della RT-PCR è stato di 6,5 giorni per il tampone faringeo e di 11 giorni (quasi il doppio) per il tampone fecale.
Nel secondo studio (10) sono stati valutati 132 pazienti affetti da Covid-19, per ciascuno dei quali è stata eseguita la RT-PCR su diversi campioni biologici. Le percentuali di positività sono:
- 38,13% tampone nasofaringeo
- 48,68% espettorato
- 3,03% sangue
- 9,83% feci
- 10% tampone anale
Un passaggio importante dello studio è il riscontro, in alcuni pazienti, di positività del campione fecale/anale a dispetto di una negatività del campione respiratorio (sia espettorato sia nasofaringeo). La spiegazione di questo fenomeno può essere ricondotta a una più lenta eliminazione (clearance) del virus nel tratto digestivo, per cui è verosimile ipotizzare che in una fase precoce dell’infezione sia maggiore la probabilità di identificare l’RNA nel tratto respiratorio e che nelle fasi più tardive sia più probabile identificare il virus nel tratto digestivo.
È indubbio ormai come la ricerca del RNA virale su più campioni biologici simultaneamente possa aumentare l’accuratezza diagnostica del test, soprattutto in pazienti con forte sospetto clinico e strumentale d’infezione da SARS-CoV2. Inoltre, i diversi tempi di conversione della RT-PCR nei vari campioni biologici possono guidare nell’interpretazione della fase d’infezione, come dimostrato da un interessante lavoro pubblicato su JAMA (11).
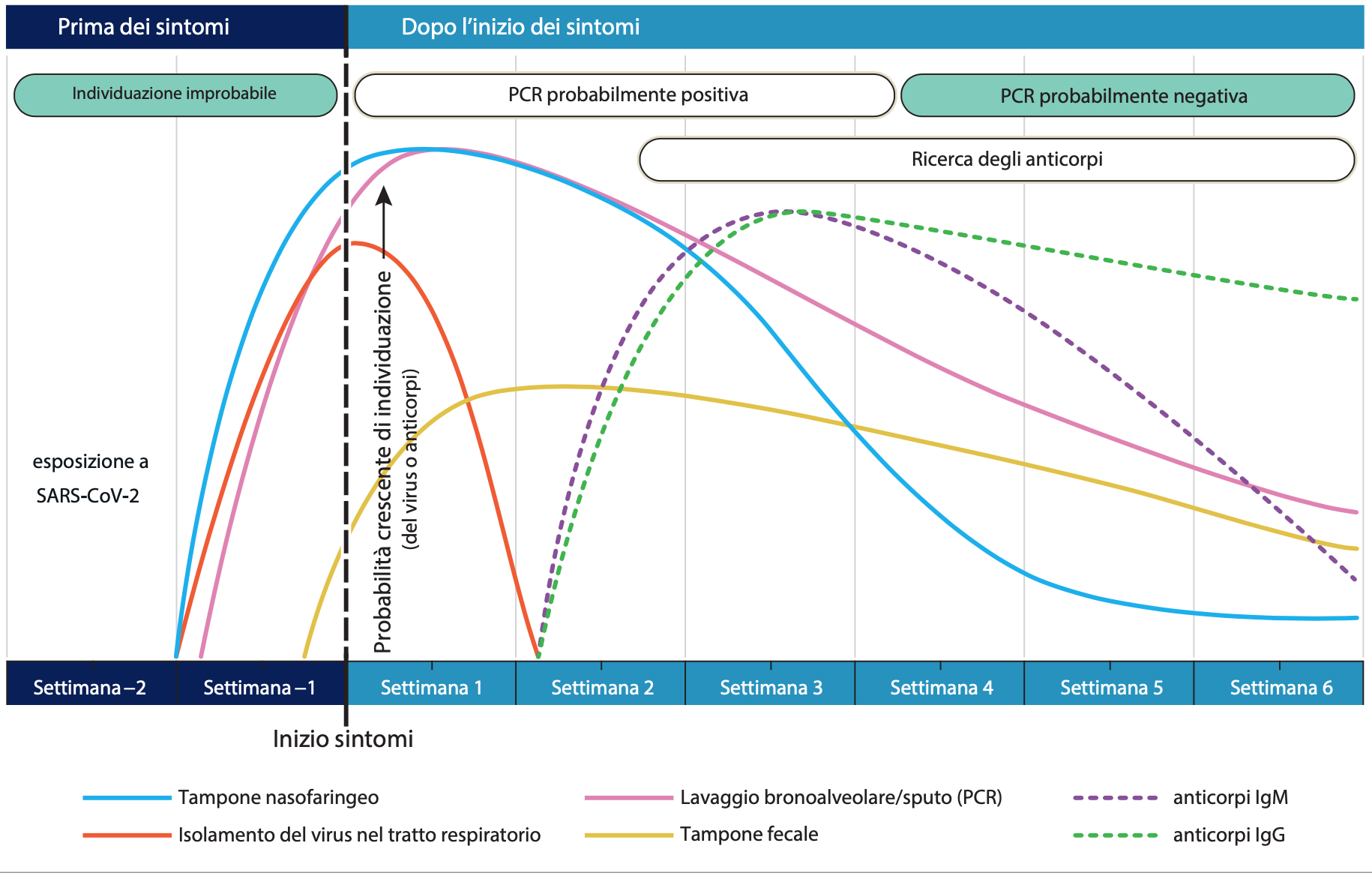
Figura 5. Stima della variazione nel tempi dei test diagnostici per l’infezione da SARS-CoV-2 in relazione all’inizio dei sintomi. Fonte: JAMA (11).
La raccolta del campione fecale/anale potrebbe essere di supporto nei pazienti con tampone respiratorio negativo in cui è controindicata l’esecuzione di un lavaggio bronchiolo-alveolare (BAL) e, soprattutto, potrebbe indicare la scelta del momento di dimissione/prosecuzione isolamento domiciliare: il riscontro di pazienti con tampone fecale/anale ancora positivo fino a 7 giorni dopo la negativizzazione del tampone respiratorio, infatti, è un dato che potrebbe indurre a considerare il risultato dell’esame tra i criteri di guarigione e non contagiosità dei pazienti. Inoltre, la sede del prelievo non espone gli operatori al rischio biologico di aerosolizzazione che, invece, può configurarsi durante la raccolta del tampone respiratorio.
Bibliografia
-
Cheng MP et al. (2020) Diagnostic testing for Severe Acute Respiratory Syndrome-related coronavirus-2: a narrative review. Ann Intern Med; M20-1301. doi: 10.7326/M20-1301
-
Gruppo di lavoro ISS Diagnostica e sorveglianza microbiologica COVID-19: aspetti di analisi molecolare e sierologica. Raccomandazioni per il corretto prelievo, conservazione e analisi sul tampone oro/nasofaringeo per la diagnosi di COVID-19. Versione del 7 aprile 2020
-
WHO. Clinical management of severe acute respiratory infection when COVID-19 is suspected. WHO/2019-nCoV/clinical/2020.4
-
Roman Wölfel R et al. (2020) Virological assessment of hospitalized patients with COVID-2019. Nature; 581: 465-69.
-
Xiong Wang X et al. (2020) Comparison of nasopharyngeal and oropharyngeal swabs for SARS-CoV-2 detection in 353 patients received tests with both specimens simultaneously. Int J Infect Dis; 94:107-09.
-
Al-Tawfiq JA et al. (2020) Diagnosis of SARS-CoV-2 infection based on CT scan vs. RT-PCR: reflecting on experience from MERS-CoV. J Hosp Infect. 2020 Mar 5. doi: 10.1016/j.jhin.2020.03.001. Online ahead of print.
-
Ai T et al. (2020) Correlation of chest CT and RT-PCR testing in coronavirus disease 2019 (COVID-19) in China: a report of 1014 cases. Radiology; 200642. doi: 10.1148/radiol.2020200642. Online ahead of print.
-
Wang W et al. (2020) Detection of SARS-CoV-2 in different types of clinical specimens. JAMA; 323(18):1843-1844. doi:10.1001/jama.2020.3786
-
Chen Y et al. (2020) The presence of SARS-CoV-2 RNA in the feces of COVID-19 patients. J Med Virol. doi: 10.1002/jmv.25825. Online ahead of print.
-
Wu J et al. (2020) Detection and analysis of nucleic acid in various biological samples of COVID-19 patients. Travel Med Infect Dis;101673. doi: 10.1016/j.tmaid.2020.101673. Online ahead of print.
-
Sethuraman N et al. (2020) Interpreting diagnostic tests for SARS-CoV-2. JAMA. doi:10.1001/jama.2020.8259