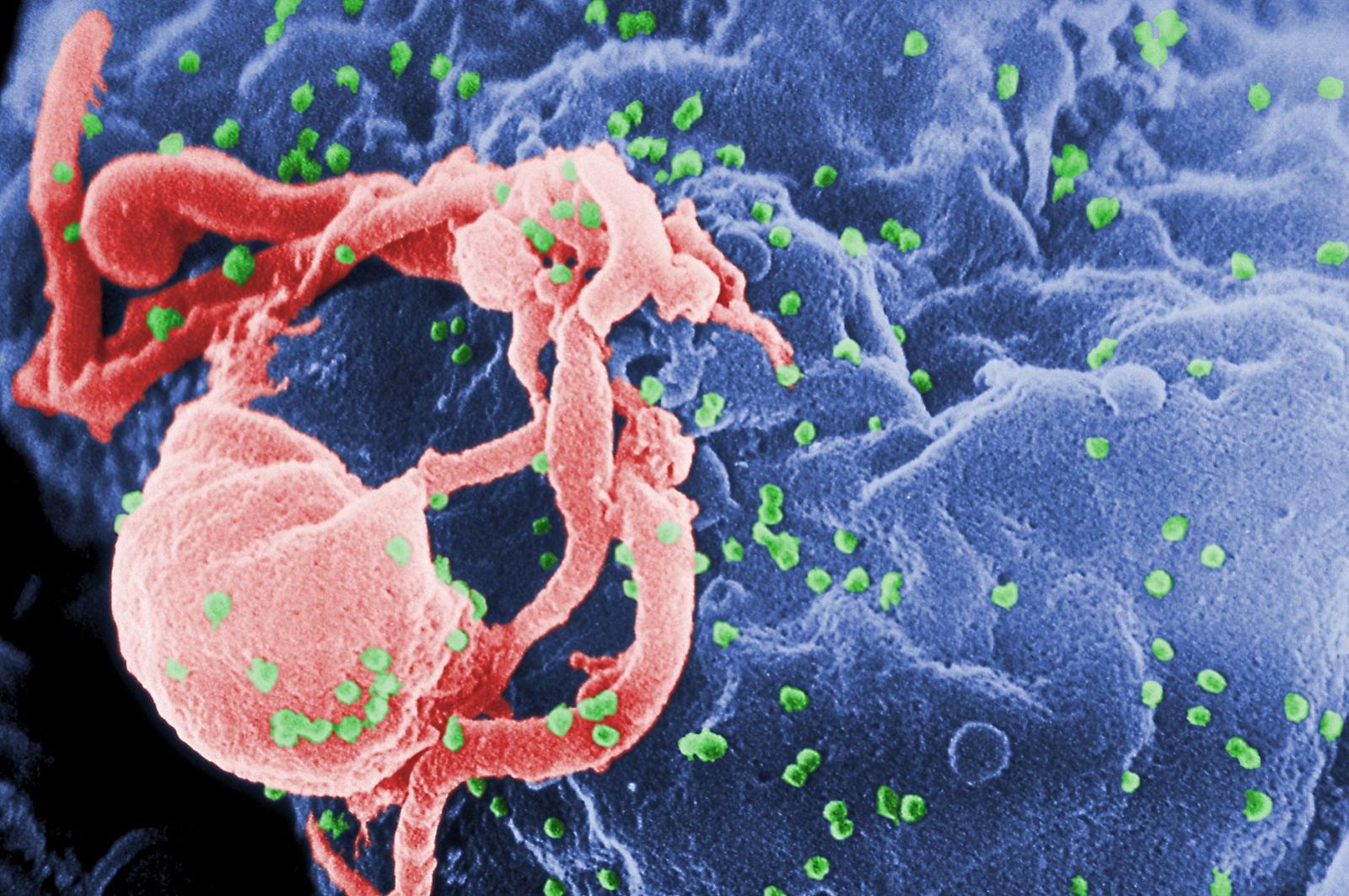
Scanning electron micrograph of HIV-1 budding (in green) from cultured lymphocyte. This image has been colored to highlight important features; see PHIL 1197 for original black and white view of this image. Multiple round bumps on cell surface represent sites of assembly and budding of virions (Wikipedia).
Esattamente 6 anni fa, nel marzo del 2013, ho scritto su questa rivista un articolo dal titolo HIV: il "paziente di Berlino", forse, non è più solo. Mi riferivo al picco d’interesse destato dalla “Mississippi Baby” alla XX Conferenza su Retrovirus e Infezioni Opportunistiche (CROI) negli USA, uno degli appuntamenti annuali più importanti della comunità scientifica che si occupa d’infezione da HIV e delle patologie correlate. L’interesse era giustificato dal caso di una bambina nata negli USA da madre non trattata con terapia antiretrovirale (ART) e la cui sieropositività fu diagnosticata in procinto del parto. La bambina fu trattata precocemente con ART dopo la nascita, senza impedirne l’infezione per cui ha continuato la terapia fino al 18esimo mese di vita quando, per motivi non chiari, ha interrotto l’assunzione di farmaci. A differenza di quasi tutte le persone che interrompono la terapia, la bambina non ha avuto l’atteso rimbalzo (rebound) della replicazione virale (che tipicamente si osserva dopo poche settimane dalla sospensione della terapia) se non dopo 27 mesi; inoltre, la bambina aveva perduto nel tempo la positività agli anticorpi (Ab) specifici per HIV a indicare come gli antigeni virali fossero scesi al di sotto di una soglia rilevabile dal sistema immunitario. Un ulteriore elemento d’interesse era l’assenza di noti geni protettivi del sistema HLA e di varianti del gene CCR5, codificante un recettore chemochinico necessario, nella maggioranza dei casi, a permettere la trasmissione e successiva propagazione del virus - definito R5 - in un singolo individuo e da un individuo all’altro, indipendentemente dalla modalità di trasmissione (sessuale, sistemica, da madre a figlio).
Un secondo co-recettore chemochinico (CXCR4) può essere infatti utilizzato dal virus nelle fasi più avanzate dell’infezione, ma raramente è sfruttato con successo da HIV nella fase iniziale di trasmissione da un individuo a un altro per motivi non ancor chiariti. E’ oramai definito senza ombra di dubbio che persone nate con una delezione omozigote nel gene CCR5 (CCR∆32) siano resistenti in modo quasi assoluto all’infezione (sono riportati una decina di casi al mondo di una loro infezione da virus utilizzante, appunto, CXCR4 e definito X4 o R5X4 se in grado di utilizzare entrambi i co-recettori d’ingresso, fermo restando la necessità da parte del virus di legare il recettore primario, ovvero la molecola CD4, espressa dai linfociti T e dai macrofagi dei tessuti), mentre la configurazione eterozigotica CCR5/CCR5∆32 comporta un’alta frequenza di resistenza naturale non all’infezione, ma alla progressione di malattia in assenza di ART (individui “long term nonprogressors” o “elite controller”).
E’ importante ricordare che le persone geneticamente deficienti per espressione di CCR5 - più frequenti in nord Europa - non hanno noti problemi di salute (a eccezione di una maggior frequenza di sviluppare una grave encefalite a seguito dell’infezione da virus West-Nile) (Lim et al. 2010).
La remissione dell’infezione da HIV nel paziente di Londra

Timothy Ray Brown, il paziente di Berlino (anlaidsonlus.it).
Al CROI di Seattle di quest’anno però il tema della remissione a lungo termine se non, addirittura, della “cura funzionale” dell’infezione da HIV (controllo spontaneo in assenza di farmaci della replicazione virale e della progressione di malattia per un tempo indefinito) è stato riproposto con forza da un caso, definito anonimamente “il paziente di Londra” che ha molte similitudini col “paziente di Berlino” (Hutter et al. 2009), descritto 10 anni prima, ma anche con alcune differenze meritevoli di considerazione (Tabella 1).
Tabella 1. Caratteristiche del “paziente di Berlino” e del “paziente di Londra”
| Note | paziente di Berlino | paziente di Londra |
|---|---|---|
| Alleli CCR5 del paziente | CCR5/CCR5∆32 | CCR5/CCR5 |
| Mantenimento della mancata espressione di CCR5 nel tempo (chimerismo totale) | presente | presente |
| Presenza di varianti virali "X4" (DNA) | nessuna | nessuna |
| neoplasia | Leucemia Mieloide Acuta | Linfoma di Hodgkin |
| n. di trapianti di cellule staminali da donatore CCR∆32 omozigote | 2 | 1 |
| Regime di condizionamento | Irradiazione corporea totale (due volte) | A bassa intensità (Alemtuzumab, anti-CD52) |
| GVHD | Grado 1 | Grado 1 |
| ART post-trapianto (durata) | nessuna | 16 mesi |
| Tempo di remissione senza evidenza di replicazione virale | >10 anni | 18 mesi |
| Negativizzazione di Ab e risposte immunitarie anti-HIV | presente | presente |
Come Timothy Ray Brown (il paziente di Berlino), anche questo secondo caso (anonimo) ha subito un trapianto di cellule staminali midollari da donatore non solo compatibile per i geni HLA, condizione necessaria per evitare il rigetto del trapianto, ma anche omozigote per la delezione CCR5∆32. Il paziente non ha più ricevuto ART dal settembre 2017 a oggi senza segni di replicazione virale, presenza di DNA virale (studiato con tecniche ultrasensibili), isolamento di virus replicante con metodiche internazionalmente accettate (su un totale di 24 milioni di linfociti T CD4+ a fenotipo “resting”, i principali se non esclusivi serbatoi a lungo termine di virus in soggetti in trattamento efficace con ART). Inoltre, come già osservato per Ray Brown e per la “Mississippi baby”, sono scomparsi sia gli Ab che le risposte dei linfociti T CD4 e CD8 specifici per proteine virali a indicare la scomparsa (o quantomeno la riduzione sotto la soglia di rilevazione del sistema immunitario) degli antigeni virali (Gupta et al. 2019).
Ovviamente, il tempo relativamente breve (circa 18 mesi) di osservazione della fase di controllo spontaneo della replicazione virale non consente di dichiarare curato il paziente, anche perché non sono state eseguite o presentate indagini su organi e tessuti, ma solo sul compartimento circolante.
Differenze fra i due pazienti
Ma il “paziente di Londra” non è (almeno per il momento) una semplice, per quanto importante, conferma e “replica” del precedente caso di Berlino. Vi sono anche differenze che potrebbero essere rilevanti nell’ottica di poter estendere questo approccio ad altri casi in cui un trapianto di cellule staminali sia una scelta terapeutica eticamente sostenibile per contrastare una neoplasia. Per inciso, leucemie e linfomi sono maggiormente frequenti nelle persone sieropositive rispetto a quelle non infettate.
La prima differenza di rilievo consiste nel fatto che il paziente londinese ha subito un solo trapianto (il paziente di Berlino ne ha ricevuti due) e un approccio di condizionamento (preparazione al trapianto) molto meno pesante e tossico rispetto al caso precedente (Tabella 1). In particolare, il paziente di Londra non ha subito l’irradiazione corporea totale finalizzata ad eliminare tutti i linfociti (ma anche altre cellule immunitarie) ed evitare la “graft-vs-host-disease” (GVHD), generata dalla reazione di rigetto dei linfociti presenti nel trapianto contro gli antigeni dell’ospite. Il paziente di Londra ha avuto una leggera GVHD 77 giorni dopo il trapianto risoltasi spontaneamente.
Al di là delle implicazioni cliniche, queste osservazioni possono essere interpretate come un argomento a favore di coloro che ritengono che il problema del “reservoir” di HIV sia confinato ai linfociti T CD4+. Infatti, se l’irradiazione totale subita da Ray Brown potrebbe aver comportato una deplezione anche di cellule immunitarie non linfocitiche, per esempio della microglia (i macrofagi residenti nel cervello noti per essere la maggior fonte d’infezione nel sistema nervoso centrale), nel caso londinese queste cellule non dovrebbero aver subito una deplezione rilevante. Per contro, l’uso prolungato di farmaci immunosoppressori, quali la ciclosporina A (CsA), somministrata fino al giorno 510 dopo il trapianto per prevenire la GVHD, potrebbe aver “spento” eventuali focolai di ripresa della replicazione virale (Rizzardi et al. 2002).
Una seconda differenza importante tra i due casi è che, a differenza di Ray Brown, il paziente recente non era geneticamente eterozigote per CCR5∆32 prima del trapianto, ma omozigote per la forma non deleta di CCR5, implicando che non sarebbe quindi necessario essere “predisposti” geneticamente a contenere la replicazione di HIV per poter essere trattati con successo mediante trapianto di staminali da donatore omozigote per la mutazione protettiva. Al riguardo, la precondizione più importante sembra essere l’accertamento di assenza di varianti virali X4 o R5X4. In questo caso sono state analizzate le sequenze di DNA dei singoli genomi virali a cui ha fatto seguito la verifica sperimentale del loro uso co-recettoriale (CCR5 vs. CXCR4). L’assenza di varianti X4 o R5X4 è una condizione comune sia al paziente di Berlino che a quello di Londra, mentre un terzo paziente “di Essen”, pur avendo subito una procedura simile, ha avuto una rapida insorgenza (3 settimane) di virus X4 poco dopo il trapianto.
Da un punto di vista concettuale questi studi, pur limitatissimi per numerosità, confermano come il virus HIV non possa evitare di servirsi di CCR5 o, in extremis, di CXCR4 per potere espandersi in un individuo e trasmettersi da questi ad altri (Poli et al 2011). Come atteso, le nuove cellule immunitarie del paziente di Londra non sono risultate infettabili in vitro da virus R5, non esprimendo il recettore sulla loro membrana, ma lo sono da parte del virus X4. In altre parole, il trapianto di cellule staminali ha conferito la resistenza attesa, ma non uno stato di resistenza assoluto a qualsiasi variante virale.
Conclusioni
Dev’essere chiaro che questo approccio non può essere assunto come schema terapeutico applicabile a tutte le persone sieropositive, ma può essere considerato per coloro che, come ricordato, devono andare incontro a un trapianto di midollo o di cellule staminali per contrastare una neoplasia resistente agli schemi tradizionali di terapia.
Più in generale, sottolineata la doverosa cautela nell’assumere che questo paziente sia stato effettivamente curato, l’implicazione dello studio ha un significato più ampio per la comunità scientifica che si occupa di questo tema, ovvero, come riassumono nella frase finale dell’articolo gli autori: «le nostre osservazioni sostengono lo sviluppo di strategie di “cura” basate sulla prevenzione dell’espressione del co-recettore d’infezione CCR5».
Post scriptum
Al CROI di Seattle 2019 è stato anche presentato il caso di un “paziente di Dusseldorf” che ha seguito un protocollo simile al “paziente di Londra” e non ha evidenza di replicazione virale, ma con un decorso post trapianto limitato a 3 mesi. (leggi qui).
Referenze
Gupta R.K. et al. HIV-1 remission following CCR5 Delta32/Delta32 haematopoietic stem-cell transplantation. Nature 2019.
Hutter G. et al. Long-term control of HIV by CCR5 Delta32/Delta32 stem-cell transplantation. N Engl J Med 2019; 360(7), 692-698.
Lim J.K. et al. CCR5 deficiency is a risk factor for early clinical manifestations of West Nile virus infection but not for viral transmission. J Infect Dis 2010; 201(2), 178-185.
Poli G. et al. Introducing the issue on "differential use of CCR5 versus CXCR4 by HIV-1. Pathogenic, translational and clinical open questions". J Transl Med 2011; 9 Suppl 1, I1.
Rizzardi G.P. et al. Treatment of primary HIV-1 infection with cyclosporin A coupled with highly active antiretroviral therapy. J Clin Invest 2002; 109(5), 681-688.
Verheyen J. et al. Rapid rebound of a preexisting CXCR4-tropic HIV variant afterallogeneic transplantation with CCR5 delta32 homozygous stem cells. Clinical infectious diseases: an official publication of the Infectious Diseases Society of America 2018; doi.org/10.1093/cid/ciy565


