Dopo 16 anni, la Conferenza Internazionale su HIV/AIDS (AIDS 2016) torna a Durban, Sud-Africa, dove il virus HIV mantiene livelli di prevalenza (con oltre 6 milioni di persone infettate) e di trasmissione da record, nonostante i molti progressi degli ultimi anni, soprattutto grazie al sempre migliore uso dei farmaci antiretrovirali che, in vari cocktail di “combination Anti-Retroviral Therapy (cART)” sono in grado di arrestare la replicazione virale, fermare la progressione di malattia nonché diminuire grandemente la trasmissione del virus ad altri e, in genere, ricostituire il danneggiato sistema immunitario per fronteggiare altre infezioni e l’insorgenza di neoplasie. Ancora in assenza di un vaccino, almeno parzialmente preventivo [unico “hit” parziale, il trial RV144 condotto in Tahilandia alcuni anni fa (1)] la cART continua a rappresentare l’unica soluzione per chi abbia acquisito l’infezione, fino al punto di suggerirne l’uso “preventivo” in alcune aree ad alta endemia e/o in popolazioni ad alto rischio (TasP, “therapy as prevention”), con pro e contro complessi. Sicuramente se ne parlerà a Durban. I limiti invalicabili della cART rimangono l’incapacità di eliminare il serbatoio (“reservoir”) di cellule già infettate, obiettivo fondamentale per raggiungere una “Functional Cure”, ovvero la riduzione del reservoir di virus infettante al di sotto di una soglia, per cui anche la sua eventuale riattivazione alla sospensione della cART non sia in grado d’innescare la propagazione virale nella persona infettata e, quindi, anche di trasmettersi ad altri individui. In questo scenario generale, diversi studi appena pubblicati sulle migliori riviste scientifiche internazionali hanno introdotto un potenziale nuovo “player”, in parte inaspettato: gli anticorpi (Ab) anti-HIV. O meglio, una superselezione di Ab, alcuni naturali, altri artificiali. Ma procediamo con ordine.
Speranze sui NAb
Gli Ab sono la principale arma per prevenire le infezioni, in quanto, a differenza dei linfociti T, interagiscono direttamente col patogeno, anche se le conseguenze di quest’interazione sono diverse e a volte contrastanti. Tuttavia, una frazione di Ab ha potere neutralizzante (NAb) verso il patogeno ed è proprio all’induzione di questo sottogruppo di Ab che mira la vaccinazione. Purtroppo, mentre alcuni vaccini funzionano benissimo, per altre infezioni, tra cui quella da HIV, i vaccini non hanno dato risultati di rilievo (con la parziale eccezione di cui sopra). Ciò non dipende dalla mancanza di una risposta anticorpale nell’infezione da HIV, tutt’altro! Si è però compreso che la maggioranza degli Ab presenti nelle persone infettate non sono protettivi e che i NAb sono prodotti solo da alcune persone infettate, a basse concentrazioni, e solo dopo diversi mesi dall’infezione (“too little and too late”). Inoltre, la maggioranza dei NAb ha una capacità neutralizzante limitata al ceppo virale dell’individuo e non di altri, per cui il virus facilmente muta e seleziona varianti resistenti agli stessi. Ma vi sono eccezioni. Da diversi anni è noto che alcuni NAb monoclonali neutralizzano un ampio spettro di virus isolati da individui diversi e, addirittura, appartenenti a diversi sottotipi (“clade”) virali: sono i cosiddetti “bNAbs (broadly neutralizing Ab)” che riconoscono porzioni diversi dello spike virale, formato da gp120 Env – la molecola che interagisce col recettore primario CD4 ed il corecettore chemochinico, entrambi essenziali per infettare la cellula – e gp41 Env, che media la fusione della membrana della particella virale (virione) con quella della cellula bersaglio (2, 3). Il valore potenziale di questi Ab eccezionali è perlomeno duplice: da un lato rappresentano potenziali farmaci “pronti all’uso”, soprattutto se somministrati in combinazione, dall’altro potrebbero rappresentare la chiave per conquistare l’insormontabile montagna che porta al vaccino preventivo. Se infatti si comprendessero le peculiarità delle porzioni di antigeni (epitopi) riconosciuti da questi super-Ab si potrebbero concepire nuovi immunogeni in grado d’indurne la produzione nella maggioranza delle persone. Su questo secondo obiettivo c’è molto investimento, mentre è già sfruttabile la potenzialità dei super-Ab di sinergizzare con i classici farmaci antivirali.
Un risultato importante
Due studi pubblicati simultaneamente su Cell (4, 5) hanno utilizzato Ab ingegnerizzati per renderli “bi-specifici”. Sfruttando la struttura ad Y delle immunoglobuline, ricercatori della Rockefeller University di New York e dell’Università di Harvard (Boston) hanno combinato un Fab specifico per il recettore CD4 o per il corecettore chemochinico CCR5 con un Fab anti-gp41 Env. Un secondo gruppo di ricercatori degli stessi istituti ha invece selezionato un Fab diretto contro il sito di legame di gp120 Env al recettore CD4 con un secondo Fab per un epitopo glicosilato della regione variabile V3 della stessa molecola virale (Figura 1).
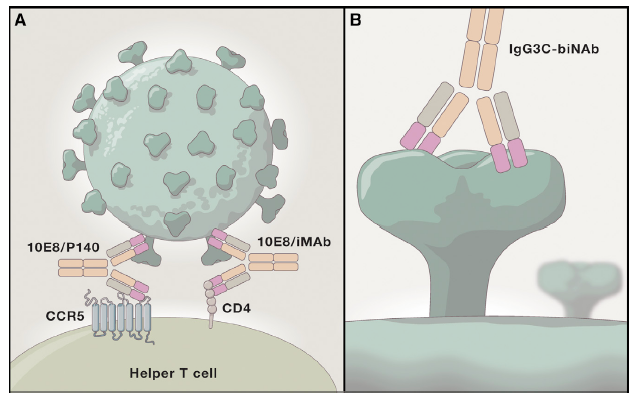
Due diversi Ab bispecifici
anti-HIV.
A. l’Ab riconosce con un Fab la
regione prossimale alla membrana di gp41 Env di HIV, con l’altro le molecole
CD4 o CCR5. B. l’Ab riconosce due epitopi diversi nel trimero della
spike, con un Fab diretto al sito di legame a CD4 e l’altro ad un sito
glicosilato della regione V3 di gp120 Env di un altro monomero. Immagine da:
(3).
Entrambi gli Ab bispecifici hanno dimostrato una notevole sinergia, raggiungendo una potenza inibitoria osservata solo in alcuni studi di combinazione di 5 bNAbs. Quindi un risultato molto importante, ancorché “in vitro”, ma di grandi potenzialità. Da un punto di vista teorico, rispetto ai classici bNAbs, a cui sono associate tipiche mutazioni virali di resistenza, non è chiaro se per il virus sarà più difficile uscire dalla “morsa” dei due siti distinti. Inoltre, il fatto che i due Ab in oggetto siano specifici per diversi punti diversi di attacco allo spike virale e/o ai recettori della cellula bersaglio rappresenta la base per pensare di poterli studiare in combinazione. Ma le novità non si fermano a questi pur importanti ricerche “in vitro”.
In uno studio appena pubblicato (ancora in versione “in press”) su Nature (6), un altro team della Rockfeller University di New York riporta i risultati di un trial clinico “open label” di fase IIa in cui l’inoculazione di un singolo bNAb anti-gp120 Env (3BNC117), specifico per legame di gp120 Env al recettore primario CD4, è stata in grado di ritardare fino a circa 10 settimane il rimbalzo della replicazione virale - contro le 2 settimane e mezza di in una coorte storica di pazienti - in 13 pazienti (selezionati in quanto il loro isolato virale era inibito da questo bNAb) a cui è stata sospesa sperimentalmente la somministrazione della cART. In alcuni pazienti, il virus emergente dopo la somministrazione dell’Ab è spesso risultato resistente ad esso, indicando un processo di selezione virale in vivo, mentre in circa il 30% dei casi ciò non si verificava ed il virus è ricomparso in circolo solo quando le concentrazioni di Ab sono scese sotto un valore soglia mantenendo peraltro immutata la propria sensibilità all’Ab.
Intanto in Italia si continua con il vaccino anti-Tat…
Anche l’Italia, a suo modo, partecipa a questo momento di grande attenzione e speranza sugli Ab, seppure con strategie atipiche sia per scelta strategica di obiettivo che di modalità di finanziamento. Mentre da un lato l’Italia riconquista una dignità perduta rifinanziando con 130 milioni di € per il triennio 2017-2019 il Global Fund per combattere AIDS, malaria e tubercolosi nei Paesi più poveri del mondo, il nostro Paese ha in concreto rinunciato da alcuni anni a sostenere con finanziamenti pubblici una propria ricerca competitiva avendo cancellato di fatto (senza mai averlo annunciato ufficialmente) il Programma Nazionale di Ricerca sull’HIV/AIDS che ci aveva fatto guadagnare una posizione di rilievo nel ranking internazionale per la qualità e quantità di pubblicazioni scientifiche e di risultati raggiunti. In questo scenario desolante sembrano resistere gli studi clinici del vaccino anti-Tat, concepiti e coordinati da Barbara Ensoli, Direttore del Centro Nazionale AIDS dell’Istituto Superiore di Sanità (ISS). In uno studio recentemente pubblicato su Retrovirology (come i due studi clinici precedenti dello stesso team) sono illustrati i risultati di una fase II condotta in Sud-Africa col sostegno di un finanziamento (circa 850.000 €) da parte del Ministero degli Affari Esteri, parte di un accordo bilaterale complessivo del valore di 22 milioni di €, “esempio di eccellenza” secondo Walter Ricciardi, prima Commissario ed ora Presidente dell’ISS, come da comunicato stampa dell’ISS e come discusso separatamente.
Si tratta di un vaccino terapeutico (e non preventivo come sostenuto in passato), collocandosi quindi nel filone discusso sopra relativamente all’uso di bNAb in pazienti infettati. Gli effetti riportati riguardano soprattutto l’immunogenicità del vaccino, somministrato a 100 persone negative per Ab anti-Tat (mentre 290 persone delle 770 originalmente esaminate sono state scartate in quanto già avevano Ab anti-Tat; scelta non commentata, ma che si presterebbe a discussioni di merito), mentre ad altre veniva somministrato un placebo. Oltre all’induzione di Ab anti-Tat, lo studio ne dimostra l’efficacia in termini d’interferenza funzionale con la proteina virale e riporta l’induzione di un modesto aumento dei linfociti T CD4+ circolanti (mediamente, ca. 60 cellule/pz) per alcuni mesi, prima del ritorno a valori di base, senza particolari variazioni della viremia (7).
Poiché tutti i pazienti hanno mantenuto l’assunzione di cART durante il periodo di studio è difficile proiettare l’importanza di questi risultati qualora venisse sospesa la cART; al riguardo, la maggioranza dei clinici “non si fida” dell’aumento di linfociti T CD4+ come predittore di successo terapeutico, soprattutto dopo l’esperienza negativa degli studi di fase III con interleuchina 2 (in grado di riportare a livelli di normalità il numero di queste cellule, senza però avere effetti protettivi sulla progressione di malattia).
Un’enfasi eccessiva?
Di questo studio colpiscono tre cose: primo, il fatto che la scommessa su Tat come immunogeno non sia perseguita nel resto del mondo (da un’analisi in Medline degli ultimi 5 anni risulta che solo altri due gruppi, uno francese e uno statunitense, abbiamo pubblicato studi clinici analoghi, con risultati diversi). Secondo, che i risultati di questa ricerca non siano stati presentati a meeting di rilievo nazionale (quale ICAR 2016, da poco conclusosi a Milano con un’affluenza di 1.300 partecipanti) o internazionali (dal programma online della Conferenza di Durban non risultano interventi di Barbara Ensoli o di suoi diretti collaboratori in agenda). Terzo, che, pur trattandosi di una pubblicazione su una rivista non di primo livello, l’ISS abbia scelto di porre grande enfasi su questi risultati, per di più alla vigilia delle selezioni dei nuovi Direttori dei propri centri di ricerca, incluso il Centro Nazionale AIDS. Un’indicazione che la strada del “Vaccino Italiano” non è ancora giunta al capolinea?
Referenze bibliografiche
1. Kim, J. H., J. L. Excler, and N. L. Michael. 2015. Lessons
from the RV144 Thai phase III HIV-1 vaccine trial and the search for correlates
of protection. Annu Rev Med 66: 423-437.
2. Julg, B., and G. Alter. 2016. Broadly Neutralizing
Antibodies: Magic Bullets against HIV? Immunity 44: 1253-1254.
3. Montefiori, D. C. 2016. Bispecific Antibodies Against HIV. Cell
165: 1563-1564.
4. Bournazos, S., A. Gazumyan, M. S. Seaman, M. C. Nussenzweig,
and J. V. Ravetch. 2016. Bispecific Anti-HIV-1 Antibodies with Enhanced Breadth
and Potency. Cell 165: 1609-1620.
5. Huang, Y., J. Yu, A. Lanzi, X. Yao, C. D. Andrews, L. Tsai,
M. R. Gajjar, M. Sun, M. S. Seaman, N. N. Padte, and D. D. Ho. 2016. Engineered
Bispecific Antibodies with Exquisite HIV-1-Neutralizing Activity. Cell 165:
1621-1631.
6. Scheid, J. F., J. A. Horwitz, Y. Bar-On, E. F. Kreider, C.
L. Lu, J. C. Lorenzi, A. Feldmann, M. Braunschweig, L. Nogueira, T. Oliveira,
I. Shimeliovich, R. Patel, L. Burke, Y. Z. Cohen, S. Hadrigan, A. Settler, M.
Witmer-Pack, A. P. West, Jr., B. Juelg, T. Keler, T. Hawthorne, B. Zingman, R.
M. Gulick, N. Pfeifer, G. H. Learn, M. S. Seaman, P. J. Bjorkman, F. Klein, S.
J. Schlesinger, B. D. Walker, B. H. Hahn, M. C. Nussenzweig, and M. Caskey. 2016.
HIV-1 antibody 3BNC117 suppresses viral rebound in humans during treatment
interruption. Nature.
7. Ensoli, B., M. Nchabeleng, F. Ensoli, A. Tripiciano, S.
Bellino, O. Picconi, C. Sgadari, O. Longo, L. Tavoschi, D. Joffe, A. Cafaro, V.
Francavilla, S. Moretti, M. R. Pavone Cossut, B. Collacchi, A. Arancio, G.
Paniccia, A. Casabianca, M. Magnani, S. Butto, E. Levendal, J. V. Ndimande, B.
Asia, Y. Pillay, E. Garaci, P. Monini, and S. M.-M. s. group. 2016. HIV-Tat
immunization induces cross-clade neutralizing antibodies and CD4(+) T cell
increases in antiretroviral-treated South African volunteers: a randomized
phase II clinical trial. Retrovirology 13: 34.


