Un modello del SARS-CoV-2 stampato in 3D. Credit: NIH / Flickr (CC BY 2.0).
Venerdì, l’Organizzazione Mondiale della Sanità ha assegnato alla nuova variante del SARS-CoV-2 B.1.1.529, l’etichetta di variante preoccupante e l’ha denominata Omicron. È stata rilevata per la prima volta in Sudafrica in un campione prelevato il 9 novembre scorso e sembra essere associata a un veloce aumento dei casi nel paese. Diversi paesi, tra cui anche l’Italia, hanno imposto limitazioni ai viaggi dal Sudafrica e da altri sei paesi del continente africano dove ci sono casi segnalati. Un primo caso di variante Omicron è stato rilevato anche in Europa, in una donna non vaccinata rientrata in Belgio dall’Egitto e senza legami diretti col Sudafrica o con gli altri sei paesi banditi. L’OMS ha invitato alla cautela. Serviranno diverse settimane per capire se il grande numero di mutazioni presenti sulla proteina spike, responsabile per l’ingresso del virus nelle cellule dell’ospite, hanno implicazioni per la diagnostica, i vaccini e i trattamenti a nostra disposizione. La preoccupazione è che possa essere più trasmissibile e capace di evadere la risposta immunitaria suscitata dai vaccini e dalle infezioni rispetto alle precedenti varianti, compresa la Delta.
Se queste ipotesi venissero confermate, è probabile che il quadro dell’epidemia cambierebbe molto nel breve e medio periodo, spingendo a riconsiderare le strategie vaccinali condotte finora, puntando finalmente a raggiungere una maggiore protezione a livello globale, e a reintrodurre l’obbligo di indossare le mascherine nei paesi che lo hanno revocato.
Tuttavia, anche se la variante Omicron si rivelasse più contagiosa o più evasiva, per il destino di lungo termine dell’epidemia una cosa è fondamentale: che rimanga poco aggressiva nei bambini molto piccoli. Se così fosse, avremmo ancora la possibilità di tendere verso un’endemia benigna o mite. Un virus è endemico quando la sua circolazione resta più o meno costante nella popolazione, ma non tutte le endemie sono uguali e non tutte sono accettabili per le nostre società.
Una misura semplice dell’accettabilità di un’endemia è il tasso di letalità medio sulla popolazione. Il virus dell’influenza è endemico e causa in Italia in media 17 000 morti ogni anno, almeno guardando alle quattro stagioni tra il 2013 e il 2016. Questo stato viene mantenuto tramite campagne di vaccinazione mirate, soprattutto verso gli anziani, che sono più a rischio di malattia grave, e i bambini, che giocano un ruolo importante nella diffusione del contagio.
Che tipo di endemia raggiungerà il SARS-CoV-2? A febbraio di quest’anno un gruppo di biologi statistici della Emory University di Atlanta ha pubblicato su Science una ricerca che ha provato a descrivere la transizione verso l’endemia di SARS-CoV-2 ispirandosi ai quattro coronavirus che circolano già in maniera endemica nella popolazione umana senza causare un grosso carico di malattia. L’ipotesi è che questi coronavirus abbiano attraversato una fase pandemica e siano diventati endemici man mano che l’età media del primo incontro con il virus si è abbassata. Questa ipotesi è basata su uno studio condotto in Cina nel 2013 che ha analizzato il sangue di circa 800 persone tra sei mesi e 74 anni di età che si sono rivolte agli ospedali della città di Pechino tra il 1999 e il 2011. Solo i bambini avevano nel circolo sanguigno gli anticorpi IgM contro i quattro coronavirus, sintomo di una infezione recente. Gli adulti avevano solo anticorpi IgG, che segnalano un incontro avvenuto nel passato con i virus. Sulla base di questi dati, i ricercatori della Emory University hanno stimato che in media la prima infezione con questi quattro coronavirus avviene tra i 4 e i 5 anni di età.
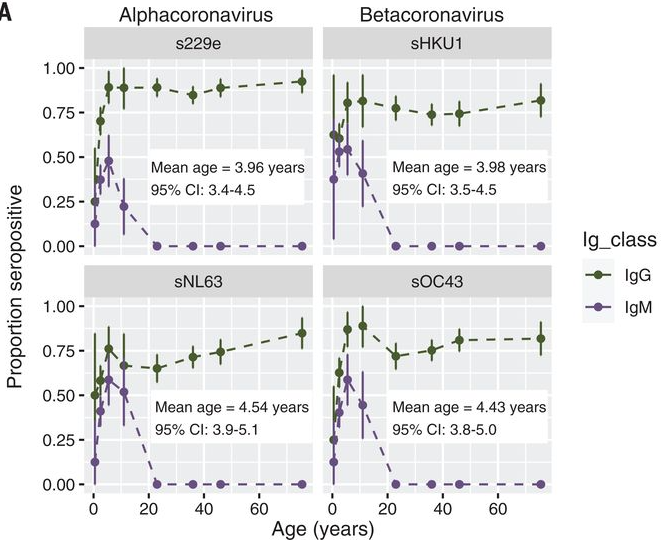
Frazione dei partecipanti allo studio del 2013 condotto in Cina con anticorpi IgM e IgG rilevati nel sangue per fascia di età. Credit: Jennie S. Lavine et al. Immunological characteristics govern the transition of COVID-19 to endemicity, Science 371(6530), pp. 741-745, 2021.DOI: 10.1126/science.abe6522
Questo suggerirebbe che i bambini incontrino i coronavirus endemici da piccoli sviluppando al più un raffreddore e ottenendo però un’immunità duratura verso la malattia grave che li protegge al momento delle reinfezioni durante la vita adulta. Che questo sia stato il percorso seguito dai coronavirus endemici è però solo un’ipotesi, perché per nessuno di questi abbiamo osservato effettivamente il passaggio da pandemia a endemia e abbiamo pochissimi dati sulla prevalenza e l’incidenza di queste infezioni nelle diverse fasce di età.
La conclusione dello studio pubblicato su Science è che quando l’età della prima infezione con SARS-CoV-2 sarà in media tra i 4 e i 5 anni di età, potremmo aver raggiunto uno stato di endemia benigna. Per arrivarci dovremo proteggere la popolazione dai 5 anni in su con vaccinazioni periodiche e lasciare che la popolazione dei nuovi nati si costruisca un’immunità duratura infettandosi naturalmente. Il tempo necessario a raggiungere questo stato di endemia benigna dipende soprattutto da due fattori: la durata dell’immunità sterilizzante e il grado di circolazione del virus.
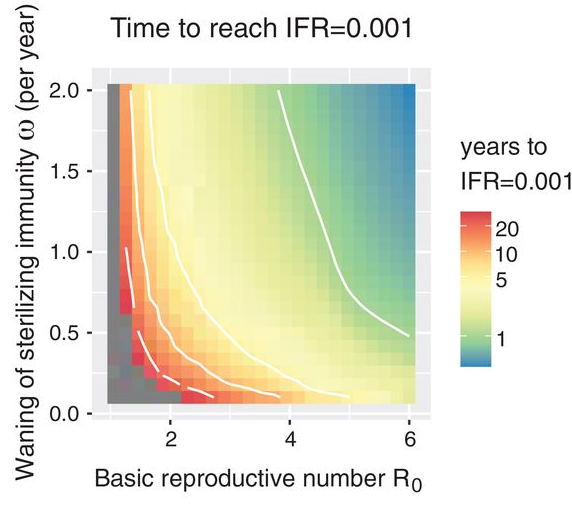
Numero di anni mancanti per raggiungere una fase endemica con tasso di letalità medio sulla popolazione dello 0,01% in funzione della velocità di diminuzione dell'immunità sterilizzante e del indice di riproduzione dell'epidemia. Credit: Jennie S. Lavine et al. Immunological characteristics govern the transition of COVID-19 to endemicity, Science 371(6530), pp. 741-745, 2021.DOI: 10.1126/science.abe6522
Tuttavia, non sappiamo ancora se un’infezione naturale da bambini con SARS-CoV-2 conferisca un’immunità duratura verso la malattia grave. La domanda è ancora aperta. Alcuni studi hanno osservato che la protezione dei vaccini dalla malattia grave diminuisce allontanandosi dalla seconda dose, anche se meno velocemente rispetto a quella dall’infezione e soprattutto nei soggetti sopra i 65 anni di età. Cosa questo implichi per l’infezione naturale non è chiaro. Sappiamo anche che le reinfezioni sono state generalmente più lievi delle prime infezioni, ma non sappiamo molto su cosa accada dopo anni dalla prima infezione, perché SARS-CoV-2 circola da poco meno di due anni, oppure cosa accada nei bambini, su cui ci sono pochi dati proprio perché sono nella maggior parte dei casi asintomatici e quindi vengono testati meno.
In effetti, un altro studio pubblicato a febbraio di quest’anno sul Journal of Infectious Diseases ha considerato la possibilità di reinfezione in 191 abitanti della città di New York che sono stati sottoposti a tampone nasale tra l’autunno del 2016 e la primavera del 2018. Di questi 12 si sono infettati più di una volta nel corso dell’indagine e gli autori hanno concluso che in generale una reinfezione con lo stesso coronavirus in meno di un anno è possibile e che la gravità dei sintomi non sembra tanto correlata a una precedente esposizione ma piuttosto a delle caratteristiche genetiche dell’ospite che evidentemente condizionano le caratteristiche della riposta adattiva ai virus. C’è da osservare che nella maggior parte dei casi gli altri quattro coronavirus causano sintomi lievi o nessun sintomo e quindi il confronto con SARS-CoV-2 ha dei limiti.
Nel caso in cui l’infezione prima dei cinque anni non conferisca un’immunità verso la malattia grave duratura nel tempo, c’è però un’altra strada che permetterebbe comunque di raggiungere un’endemia benigna, come spiegano Rustom Antia di Emory University e Elizabeth Halloran del Fred Hutchinson Cancer Research Center in questo articolo divulgativo pubblicato sulla rivista Immunity a fine ottobre. Basterebbe infatti che la protezione dalla malattia grave durasse un po’ più a lungo di quella dall’infezione, come sembra succedere con i vaccini. Ci sarebbe così una finestra temporale in cui diventeremmo di nuovo suscettibili all’infezione ma senza conseguenze gravi. Un incontro con il virus in quella finestra funzionerebbe da richiamo “naturale” dell’immunità.

Transizione stilizzata da pandemia a endemia (sinistra) e finestra temporale di reinfezione senza rischio di decorso clinico grave (destra). Credit: Rustom Antia, M. Elizabeth Halloran, Transition to endemicity: Understanding COVID-19, Immunity 54(10), pp. 2172-2176, 2021. DOI:/10.1016/j.immuni.2021.09.019
È importante sottolineare che questi scenari richiedono un buon grado di circolazione del virus, tale da permettere un’infezione sufficientemente precoce nei bambini e sufficientemente frequente negli adulti per richiamare continuamente la loro protezione verso le forme gravi della malattia.
Da questo punto di vista la vaccinazione dei bambini molto piccoli potrebbe essere addirittura controproducente. In un editoriale pubblicato sul British Medical Journal a maggio, Jennie Lavine, biostatistica della società biotecnologica Kairus e autrice dello studio pubblicato su Science a febbraio, ha osservato che la vaccinazione dei bambini piccoli avrebbe come obiettivo principale la riduzione della trasmissione del virus, ma «una volta che la maggior parte degli adulti saranno stati vaccinati, la circolazione di SARS-CoV-2 potrebbe in effetti essere auspicabile, poiché è probabile che porti a un'infezione primaria molto presto nella vita quando la malattia è lieve, seguita da riesposizioni di richiamo durante l'età adulta quando l'immunità che blocca l’infezione diminuisce ma l'immunità che blocca la malattia rimane alta. Questo manterrebbe le reinfezioni lievi e l'immunità aggiornata». Tuttavia sottolinea che «nuove varianti stanno emergendo man mano che il virus si adatta all’ospite umano ed è quindi essenziale continuare a monitorare la gravità della malattia in tutti i gruppi di età».
Questi scenari guardano al lungo periodo e sono formulati usando dei modelli molto semplificati dell’epidemia. Le decisioni di sanità pubblica nel medio termine devono basarsi su ciò che sappiamo e che non sappiamo ora. Inoltre, non possono limitarsi a considerare solo gli effetti immediati dei contagi, cioè i decessi che causano, ma devono guardare anche alle conseguenze di lungo termine.
Il punto più delicato è l’opportunità di vaccinare o meno i bambini sotto i cinque anni, quando, probabilmente entro la primavera del prossimo anno, i vaccini saranno approvati anche per questa fascia di età. Non sappiamo infatti quali siano gli effetti di lungo termine dell’infezione nei bambini piccoli e questo potrebbe spingere le autorità di salute pubblica a raccomandarne la somministrazione in attesa di capire di più. La decisione a somministrare i vaccini anche anti-Covid sotto I cinque anni potrebbe essere opportuna anche nel caso in cui la popolazione adulta non fosse ancora sufficientemente protetta e la diminuzione della trasmissione derivante dalla vaccinazione dei bambini aiuterebbe a proteggere le fasce ancora a rischio della popolazione.
Sugli effetti di lungo termine dell’infezione si sa di più negli adulti. La sindrome post-Covid-19, in inglese long Covid, comporta la persistenza di diversi sintomi a più di quattro settimane dall’infezione con SARS-CoV-2, tra cui fatica cronica, respiro corto, difficoltà di concentrazione, mal di testa e dolori muscolari. La prevalenza di questa condizione tra coloro che si sono infettati è difficile da stimare perché non sono ancora definiti con chiarezza i criteri di diagnosi. Tuttavia, l’Office for National Statistics britannico conduce un sondaggio periodico su circa 25 mila persone e a settembre ha stimato che circa il 2,5% di coloro che si infettano lamentano uno o più di questi sintomi a 12 settimane dall’infezione, ridimensionando il 10% circa stimato ad aprile. Non è ancora chiaro di quanto si riduca il rischio di long Covid in coloro che si infettano dopo la vaccinazione. Molte risposte dovrebbero arrivare dallo studio RECOVER, finanziato con un miliardo e mezzo di dollari dai National Institutes of Health statunitensi, che per i prossimi quattro anni indagherà sulle conseguenze di lungo termine dell’infezione coinvolgendo decine di migliaia di partecipanti. In ogni caso una condizione cronica, anche se con una bassa incidenza nella popolazione che si infetta, può rappresentare un carico insostenibile per il sistema sanitario.
Al di là del long Covid, potrebbero esserci impatti di lungo periodo sulla produttività che non stiamo ancora misurando. Una risposta è arrivata a fine ottobre da un settore molto particolare, quello del calcio. Una ricerca condotta da un gruppo di economisti e che ha misurato i cambiamenti nelle performance di un gruppo di calciatori della Bundesliga e della Serie A, le due leghe maggiori del campionati di calcio tedesco e italiano, fino a 15 settimane dopo l’infezione con SARS-CoV-2. I ricercatori hanno trovato che tutta una serie di misure di performance, come il numero di passaggi, di palle recuperate e la distanza percorsa, sono diminuite di circa il 6% subito dopo l’infezione e sono rimaste comunque il 5% inferiori anche sei mesi dopo l’infezione. Concludono i ricercatori che «i nostri risultati potrebbero avere importanti implicazioni per il mercato del lavoro e la salute pubblica in generale. I paesi e le aziende con un maggiore numero di contagi potrebbero subire svantaggi economici aggiuntivi rispetto allo shock temporaneo dovuto alle misure restrittive imposte nelle prime fasi della pandemia, per via di una riduzione della produttività potenzialmente duratura».
Per ricevere questo contenuto in anteprima ogni settimana insieme a sei consigli di lettura iscriviti alla newsletter di Scienza in rete curata da Chiara Sabelli (ecco il link per l'iscrizione). Trovi qui il testo completo di questa settimana. Buona lettura, e buon fine settimana!


