|
 |
Bolla
galleggiante
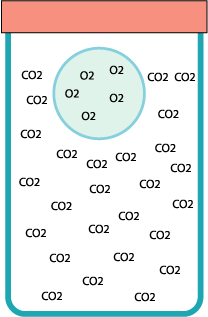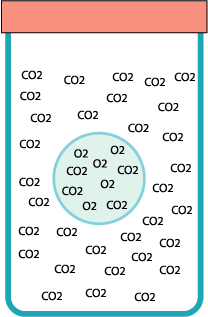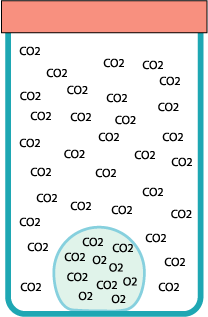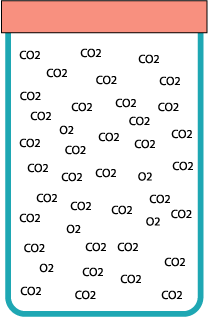
Una bolla
di sapone può “galleggiare” immobile all’interno di un barattolo.
Trucco:
il barattolo è pieno di anidride carbonica.
Si può
decidere dall’inizio se portare un barattolo già pieno di anidride carbonica
e ben sigillato (magic science) o se mostrare tutta la preparazione. Con i
bambini di 5ª di Sambucheto, nella primavera 2003, abbiamo optato per la
seconda soluzione. Alla fine essi stessi hanno: 1. spiegato tutti i fenomeni
osservati, 2° ri-effettuato l’esperimento da soli per mostrarlo alle
altre classi. |
|
|
|
|
 |
Predisporre i materiali come
nella foto. Meglio mettere all’inizio un’abbondante riserva di bicarbonato.
Notare che nel tubo di gomma ci sono due batuffoli di ovatta infilati alle
estremità, per evitare che l’areosol (che si forma quando si mette l’aceto
sul bicarbonato) entri appannando e bagnando il fondo del barattolo. Per
evitare che a causa delle correnti d’aria l’anidride carbonica esca dal
barattolo conviene chiudere con un cartoncino forato per far passare il tubo
o con lo stesso tappo a vite spostato leggermente (l’anidride tende a
rimanere in basso, come se fosse un liquido, anche se il tappo è aperto) |
|
|
 |
L’aceto va versato poco per
volta, senza agitare. Quindi si preme il tubo nel collo dell’imbuto e si
agita gradualmente, in modo da controllare la schiuma ed evitare che vada a
finire nel tubo. Il gas attraverserà l’ovatta ed entrerà nel barattolo,
stratificandosi dal basso e scacciando l’aria dalla sommità. |
|
|
 |
L’aceto va versato poco per
volta, senza agitare. Quindi si preme il tubo nel collo dell’imbuto e si
agita gradualmente, in modo da controllare la schiuma ed evitare che vada a
finire nel tubo. Il gas attraverserà l’ovatta ed entrerà nel barattolo,
stratificandosi dal basso e scacciando l’aria dalla sommità. |
|
|

|
Dopo 4 o 5 immissioni (si
tenga presente che ogni decilitro di aceto origina circa un litro di
anidride carbonica, considerate le perdite, e consuma 4 g di bicarbonato) si
può iniziare a vedere se il barattolo è pieno, infilando dall’alto un
fiammifero acceso. |
|
|
|

|
Se questo si spegne
all’istante vuol dire che il barattolo è pieno e lo si può chiudere.
Ovviamente disponendo di una bombola di anidride carbonica compressa o di un
estintore aperto ad anidride carbonica, l’operazione di riempimento sarebbe
molto più agevole. |
|
|
|

|

|
| |
|
Preparazione della saponata per le bolle: un cucchiaio di
zucchero sciolto in 4 cucchiai di acqua distillata calda, aggiungere a
caldo un volume uguale di detersivo liquido per piatti e agitare a lungo con
il cucchiaio. Chiudere in un barattolino per l’uso successivo.
Con una cannuccia
provare a formare le bolle di 6-8 cm di diametro e a staccarle, operazione
che dovrà essere effettuata sull’imboccatura del barattolo una volta aperto |
| |
|

|
 |
| |
|
Aprire il barattolo svitando il coperchio e facendolo
poi scorrere orizzontalmente e lentamente, per evitare rimescolamenti
eccessivi con l’aria soprastante.
Il metodo migliore è di soffiare le bolle con la
cannuccia immersa nel barattolo. Quando saranno abbastanza grandi saliranno
da sole ancor prima di staccarsi dalla cannuccia. Se si staccano bolle
troppo piccole queste cadranno sul fondo. Se il barattolo è ben pieno di gas
la bolla galleggerà in cima alla sua superficie. Appena scende un po’ al
disotto dell’orlo si può chiuderla nel barattolo. La bolla è intrappolata! |
|
|











