L’ultima emergenza globale che riempie i notiziari e le pagine dei quotidiani è una malattia respiratoria, in alcuni casi grave e anche mortale, causata da un nuovo Coronavirus (CoV) definito “2019-nCoV” scaturito dalla città di Wuhan, in Cina. Come le altre epidemie da CoV pericolose per la salute umana, causando la SARS e la MERS, anche quest’ultima è quasi sicuramente una zoonosi, ovvero una patologia innescata dal “salto di specie” di un virus da un serbatoio animale all’uomo. E’ da sottolineare che prima della SARS questa famiglia di virus era considerata di scarsa rilevanza per la salute umana causando principalmente il banale raffreddore (Immagine: coronavirus, 1975; crediti: Centers for Disease Control and Prevention's Public Health Image Library).
SARS-CoV
Alla fine di gennaio 2003 ricevemmo un campione biologico (sputo) di un paziente italiano tornato dalla Cina e ricoverato al Dipartimento di Malattie Infettive dell’Ospedale “Luigi Sacco” di Milano con sintomi respiratori gravi e dove fu diagnosticato affetto da questa nuova patologia virale (“Severe Acute Respiratory Syndrome, SARS”). Rapidamente isolammo il virus su colture di cellule VERO (prive della capacità di sintetizzare interferone e quindi molto permissive alle infezioni virali) (Figura 1) e, altrettanto rapidamente, lo sequenziammo (1); fu il secondo isolato europeo di Coronavirus della SARS (ceppo HSR1).
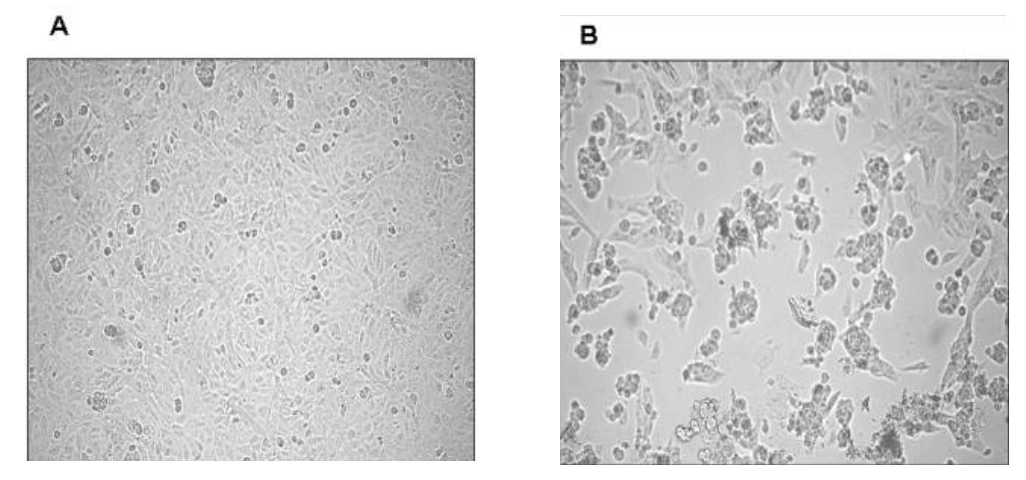
Figura 1. Effetto citopatico del SARS-CoV su cellule VERO. Il tappeto di cellule affusolate non infettate (A) subisce un profondo cambiamento morfologico associato a morte cellulare indotto dall’infezione virale. Da: E. Vicenzi et al., Emerging Infectious Diseases, 2004.
Com’è noto, l’epidemia di SARS, innescata negli ultimi mesi del 2002 a Guangzhou (Canton) (Figura 2), città di 11,5 milioni di abitanti di fronte a Hong-Kong nella provincia del Guangdong, venne spenta rapidamente nel giugno 2003 esclusivamente grazie a misure di contenimento, ovvero isolando i pazienti e mettendo in quarantena i contatti dopo che si era capito che l’infezione si propagava soprattutto nel personale sanitario (Carlo Urbani, medico italiano, fu il primo a comprendere la severità della nuova infezione virale e a allertare l’OMS), rimanendone poi infettato e pagando con la propria vita la sua dedizione alla salute delle popolazioni) e attraverso le persone che andavano in ospedale a visitare i ricoverati e quindi diffondevano il virus all’esterno.
Il meccanismo di trasmissione zoonotica del SARS CoV fu in seguito chiarito: il serbatoio naturale (“reservoir”) del virus erano i pipistrelli (suddivisi in ca. 1200 specie, il 20% di tutti i mammiferi), ma il passaggio all’uomo, come molto spesso avviene nelle zoonosi, avvenne attraverso un ospite intermedio: lo zibetto (“palm civet”), considerato una delicatezza alimentare e perciò venduto nei mercati alimentari cinesi di Guangzhou. La conta finale delle infezioni fu di ca. 8000 casi, con una mortalità di ca. il 10%, soprattutto tra anziani e pazienti con comorbidità (patologie cardiovascolari, diabete, ecc.), frequenti in questa popolazione. Dopo la Cina la nazione più colpita fu il Canada (375 infezioni e 44 morti).
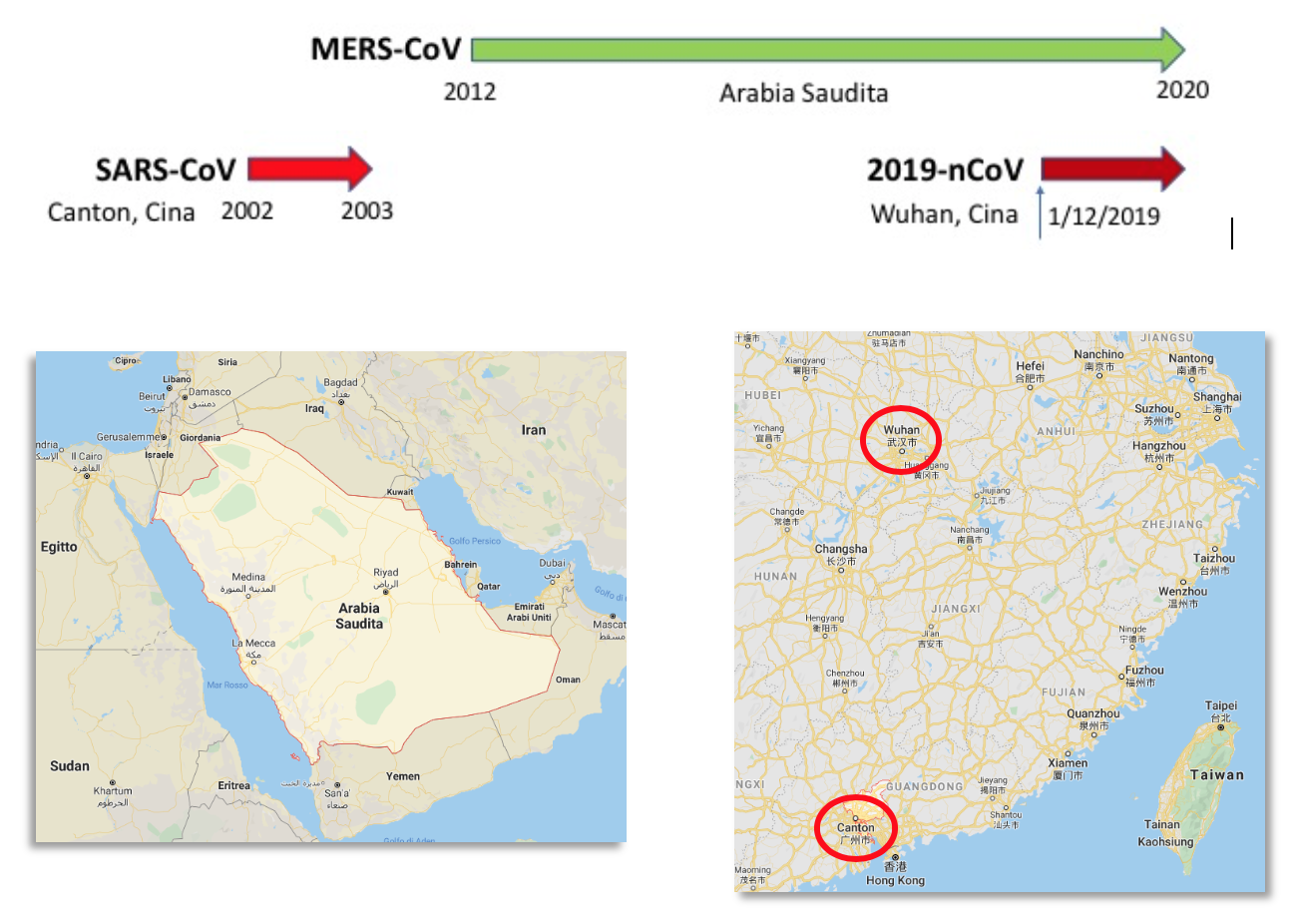
Figura 2. Coronavirus ad alta patogenicità per l’uomo. Origine dei focolai epidemici.
Il meccanismo principale alla base della letalità indotto da questo virus è la cosiddetta “Sindrome da distress respiratorio acuto (ARDS)” per cui, dopo l’infezione dell’epitelio delle vie respiratorie inferiori mediata dall’interazione della proteina di superficie (“Spike”) del virus con il recettore d’ingresso ACE2 (“Angiotensin Converting Enzyme 2”) si scatena una violenta infiammazione acuta dei polmoni che porta alla formazione di una cotenna di fibrina sugli alveoli polmonari impedendo così i vitali scambi gassosi. L’ARDS è una condizione molto grave che richiede interventi complessi quali l’ECMO (“Extra-Corporeal Membrane Oxygenation”) da parte di personale medico specializzato. Non un farmaco né un vaccino sono stati identificati in questo breve periodo, anche se la ricerca è proseguita per alcuni anni.
La fine dell’emergenza, com’è naturale, è stata salutata da un grande respiro di sollievo internazionale. Tuttavia, purtroppo, la lezione puntualmente impartita dagli “outbreak” zoonotici (anche l’infezione da HIV nasce come zoonosi prima di divenire una patologia trasmessa mediante rapporti sessuali non protetti, trasfusione o contatto con sangue infetto o sue componenti e attraverso l’allattamento al seno) non è stata recepita sufficientemente e si è tornati al “business as usual” fino a quando una nuova infezione a potenziale pandemico, per esempio da parte del virus influenzale, o seppure a diffusione locale ma altamente mortale come l’epidemia da virus Ebola in Africa occidentale nel 2014, un nuovo “outbreak” virale non torni a “fare notizia”.
Va sottolineato come la fine dell’epidemia di SARS non significhi affatto la scomparsa del virus dal suo serbatoio naturale (i pipistrelli) e che nulla, in linea di principio, ci autorizzi a pensare che futuri “outbreak” non siano possibili.
MERS-CoV
Archiviata dalla memoria collettiva la SARS, nel 2012 si accumularono casi di polmoniti virali complicate e spesso mortali localizzate geograficamente in Arabia Saudita e, in misura minore, in altre aree del Medio Oriente (Figura 2), per cui fu definita “Middle-East Respiratory Syndrome (MERS)”. A differenza della SARS, i pazienti affetti da MERS presentavano importanti complicazioni intestinali e spesso un danno renale acuto. Questo diverso spettro clinico è stato correlato a un diverso recettore d’ingresso virale, ovvero dal legame della Spike alla molecola CD26 (dipeptidil-peptidasi 4, DPP4) espressa non solo dall’epitelio delle basse vie respiratorie, ma anche da quelle dell’apparato intestinale e renale (2). Come per la SARS l’agente causale fu rapidamente isolato e si scoprì che apparteneva alla stessa famiglia di virus della SARS: i coronavirus.
Il serbatoio virale del nuovo coronavirus era sempre il pipistrello, ma l’ospite intermedio fu identificato nei cammelli e dromedari, animali molto integrati nella vita e nell’economia di quell’area geografica, spesso utilizzati, per esempio, per accompagnare turisti in escursione nel deserto. A differenza della SARS, la MERS non è mai scomparsa e l’infezione continua a trasmettersi all’uomo dai camelidi mentre la trasmissione uomo-uomo ha colpito soprattutto gli operatori sanitari che hanno curato i pazienti (3). A dicembre 2019, si contavano 2.499 casi e 861 morti da MERS (34%).
A differenza della SARS non ci sono evidenze epidemiologiche che suggeriscano che quest’infezione possa estendersi al di fuori dell’area geografica interessata. Anche per la MERS, né farmaci specifici né vaccini sono stati sviluppati per cui ci si limita a misure di contenimento e prevenzione della trasmissione secondaria.
2019-nCoV (new coronavirus)
L’ultimo esempio d’infezione a potenziale pandemico e associata ad una significativa mortalità (circa il 2%, stando ai dati attuali) è rappresentata del coronavirus di Wuhan, provincia di Hubei, città di 11 milioni di abitanti distante circa 1.000 Km a sud da Canton (Figura 2). Gli aspetti generali di questa nuova epidemia sono noti e costantemente aggiornati dai media, oltre che dagli organi ufficiali d’informazione, per cui ci limiteremo ad alcune informazioni più tecniche, spesso omesse dai canali principali d’informazione.
Il Virus. il virus definito “2019-nCoV (new CoronaVirus)” ha importanti omologie di sequenza (circa 76%) col virus della SARS sebbene ci sia variabilità da regione a regione della sequenza virale. Al riguardo va sottolineato che i coronavirus sono tra i virus a RNA più lunghi, circa 30 Kb (HIV, per confronto, è lungo circa 9 Kb).
Il virus è stato isolato prima dai ricercatori cinesi utilizzando colture primarie di pneumociti umani e cellule VERO, successivamente, da ricercatori australiani dell’Istituto Peter Doherty di Melbourne partendo da un tampone faringeo di un paziente e utilizzando cellule epiteliali primarie umane ottenute dalle vie aeree come bersaglio cellulare (4). Notizia recentissima, il virus è stato isolato anche dall’Istituto Nazionale di Malattie Infettive “Lazzaro Spallanzani” di Roma. La disponibilità dell’intera sequenza genomica del virus e di più isolati virali (messi a disposizione della comunità scientifica internazionale dai ricercatori che li hanno ottenuti) rappresenta un prezioso presupposto per arrivare rapidamente ad affinare le conoscenze sulle caratteristiche peculiari di questo nuovo coronavirus e, soprattutto, per la messa a punto di test diagnostici e lo screening di potenziali farmaci.
Come il virus della SARS, anche 2019-nCov utilizza ACE2 come recettore d’ingresso nelle cellule epiteliali delle vie respiratorie inferiori (sia umane che di pipistrello) (5). Questa osservazione è importante non solo per confrontare le caratteristiche dei due virus, ma anche perché implica che eventuali farmaci, inclusi anticorpi monoclonali generati a suo tempo contro il virus della SARS, dovrebbero essere in grado di interferire e forse bloccare entrambe le infezioni; risultati preliminari ancora non pubblicati supportano quest’ipotesi.
Il serbatoio naturale. Manco a dirlo, anche per questo virus è quasi sicuramente rappresentato dai pipistrelli. Il virus sequenziato da questi ultimi ha fortissime omologie di sequenza col virus umano (96%) per cui è sostanzialmente certo (anche per le conoscenze già acquisite con SARS e MERS) che la provenienza sia attribuibile a questi mammiferi (6). Tuttavia, non è ancora stato identificato un ospite intermedio (si ipotizza anche una trasmissione diretta dai pipistrelli) e la stessa trasmissione zoonotica dal mercato del pesce di Wuhan (che ospita anche altri animali) non è stata accertata in tutti i casi; infatti, tra i primi casi ricoverati in Cina diversi non avevano visitato o acquistato animali o loro parti nel mercato suddetto.
I farmaci disponibili. Non esistono al momento farmaci specifici contro i coronavirus patogeni per l’uomo. Tuttavia, durante la pandemia di SARS, venne somministrato il medicinale Kaletra, contenente due farmaci (lopinavir e ritonavir) inibitori dell’enzima virale proteasi di HIV che si dimostrò efficace nell’attenuare i sintomi dell’ARDS e diminuire quindi la mortalità dei pazienti trattati. Poiché lo studio non comprendeva un gruppo di controllo non trattato non vi è la prova definitiva di un effetto protettivo contro SARS (7), né è chiaro il meccanismo d’azione antivirale esercitato verso il coronavirus, molto diverso da HIV. Tuttavia, è recente la notizia che un gruppo di ricerca Thailandese avrebbe osservato un effetto protettivo anche contro la nuova infezione da 2019-nCov. Inoltre, è disponibile un farmaco, il remdesivir, inibitore a largo spettro di RNA polimerasi virali che ha dimostrato una certa efficacia sia in vitro che in modelli animali di SARS e MERS-CoV (8). Ne è stato ipotizzato l’uso a Wuhan e altre aree interessate in formato di spray per la gola alla comparsa dei sintomi, sebbene la sua efficacia clinica sia tutta da dimostrare.
Lo sviluppo di un vaccino preventivo. Nella comunicazione quotidiana, ma anche nelle discussioni tra esperti, registriamo confusione sul tema vaccino. Innanzitutto, va chiarito che i vaccini sono potentissimi strumenti di prevenzione, ovvero funzionano (quando funzionano) se somministrati alla popolazione a rischio o a quella generale prima della potenziale esposizione all’infezione. I vaccini cosiddetti “terapeutici” rappresentano invece una forma di terapia di soggetti già infettati e sono più un oggetto di ricerca sperimentale (anche in campo oncologico) che non una realtà concreta nel controllo di malattie infettive.
Nello specifico, è stato enfatizzato che, grazie alle moderne tecnologie, si potrà arrivare in poche settimane o mesi allo sviluppo di un vaccino. In realtà si dovrebbe parlare di candidati vaccinali che dovranno seguire il percorso predefinito di fase 1 (tossicità), fase 2 (dosaggio, modalità di somministrazione) e fase 3 (efficacia clinica) che non potrà essere compresso nel tempo più di tanto, nella migliore delle ipotesi almeno un anno, un tempo non realisticamente utile per la presente epidemia, almeno per quanto ne sappiamo oggi.
Va sottolineato tuttavia che la presente epidemia di 2019-nCov ha caratteristiche più subdole rispetto a quella della SARS, tra cui la dimostrata capacità di trasmissione virale da persona in fase d’incubazione e asintomatica – che l’OMS definisce “non un mezzo principale d’infezione”.
Considerazioni sugli indici di mortalità. Sebbene allo sguardo inesperto sembrerebbe semplice definire la mortalità di una determinata condizione patologica, in questo caso un’infezione virale, così non è. Proviamo a sintetizzare. La definizione del “case fatality rate (CFR)” è basata sul numero di casi diagnosticati, ma necessita anche la conoscenza dell’esito delle infezioni (guarigioni vs. morti) per cui non è possibile stimarla in un’epidemia in corso. Se si aggiunge poi la possibilità di trasmissione asintomatica (con i caveat di cui sopra) ciò complica di molto una definizione accurata del CFR. Durante un’epidemia in corso è quindi più utile fare riferimento al “proportion of fatal cases (PFC)” che si ottiene dividendo il numero di morti causate dall’infezione per il numero dei casi diagnosticati; per quanto riguarda 2019-nCoV la PFC è per il momento del 2% (circa 20 volte superiore a quella dell’influenza stagionale).
Più semplice e utile la definizione di “population mortality rate (PMR)” dove al denominatore è indicata la frazione di popolazione potenzialmente infettabile; al momento non si segnalano casi gravi al di sotto i 16 anni di età, per motivi ancora sconosciuti, per cui il numero di soggetti potenzialmente infettabili che possano andare incontro ad un’evoluzione grave e mortale dell’infezione è comunque molto alto (9).
Conclusioni, necessariamente preliminari. Non abbiamo ancora un quadro completo dell’impatto complessivo che avrà l’infezione da 2019-nCov sulla salute umana nelle aree dove è stata accertata la presenza dell’infezione e a livello globale a differenza di quanto sta già avvenendo a livello economico, dove è stimato che l’impatto sull’economia cinese non sarà inferiore a 60 miliardi di dollari (la SARS causò perdite in Cina, allora quarta potenza economica mondiale dopo USA, Giappone e Germania, per circa 33 miliardi di dollari). Questa discrepanza tra i tempi necessariamente “lenti” di una nuova epidemia (in cui bisogna imparare a conoscere il nuovo nemico e le sue caratteristiche per allestire strategie efficaci di contenimento e prevenzione) contrasta con l’immediatezza del suo impatto sull’economia globale, alimentato e amplificato dall’accesso globale a internet e dai social network.
Una speranza e un auspicio è che questa nuova epidemia faccia riflettere le istituzioni e la classe politica sulla necessità di non chiudere il finanziamento alla ricerca su questi e altri virus una volta che i riflettori si saranno spenti, ma che, fuori dall’emergenza, si sostengano concretamente le molte competenze in ambito clinico, epidemiologico, virologico e immunologico per creare network di centri clinici e laboratori pronti a scendere in campo entro 24h in caso di una nuova epidemia. Le epidemie virali a potenziale pandemico, quale quella in corso da 2019-nCoV, suggeriscono un’analogia con i terremoti: la domanda non è “se” ci saranno nuovi eventi, ma “quando, dove e di quale gravità”.
Referenze
1. Vicenzi E, Canducci F, Pinna D, Mancini N, Carletti S, Lazzarin A, Bordignon C, Poli G, Clementi M. 2004. Coronaviridae and SARS-associated coronavirus strain HSR Emerg Infect Dis 10:413-8.
2. Song Z, Xu Y, Bao L, Zhang L, Yu P, Qu Y, Zhu H, Zhao W, Han Y, Qin C. 2019. From SARS to MERS, Thrusting Coronaviruses into the Spotlight. Viruses 11.
3. Elkholy AA, Grant R, Assiri A, Elhakim M, Malik MR, Van Kerkhove MD. 2019. MERS-CoV infection among healthcare workers and risk factors for death: Retrospective analysis of all laboratory-confirmed cases reported to WHO from 2012 to 2 June 2018. J Infect Public Health doi:10.1016/j.jiph.2019.04.011.
4. Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, Zhao X, Huang B, Shi W, Lu R, Niu P, Zhan F, Ma X, Wang D, Xu W, Wu G, Gao GF, Tan W, China Novel Coronavirus I, Research T. 2020. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med doi:10.1056/NEJMoa2001017.
5. Hoffmann M, Kleine-Weber H, Krueger N, Mueller MA, Drosten C, Poehlmann S. 2020. The novel coronavirus 2019 (2019-nCoV) uses the SARS-coronavirus receptor ACE2 and the cellular protease TMPRSS2 for entry into target cells. BioRxiv https://doi.org/10.1101/2020.01.31.929042
6. Paraskevis D, Kostaki EG, Magiorkinis G, Panayiotakopoulos G, Sourvinos G, Tsiodras S. 2020. Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event. Infect Genet Evol doi:10.1016/j.meegid.2020.104212:104212.
7. Chu CM, Cheng VC, Hung IF, Wong MM, Chan KH, Chan KS, Kao RY, Poon LL, Wong CL, Guan Y, Peiris JS, Yuen KY, Group HUSS. 2004. Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax 59:252-6.
8. Sheahan TP, Sims AC, Leist SR, Schafer A, Won J, Brown AJ, Montgomery SA, Hogg A, Babusis D, Clarke MO, Spahn JE, Bauer L, Sellers S, Porter D, Feng JY, Cihlar T, Jordan R, Denison MR, Baric RS. 2020. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERS-CoV. Nat Commun 11:222.
9. Taubenberger JK, Morens DM. 2006. 1918 Influenza: the mother of all pandemics. Emerg Infect Dis 12:15-22.