L'FDA ha recentemente autorizzato l'uso dei vaccini a mRNA nei bambini di età compresa tra i 6 mesi e i 5 anni, e in autunno è previsto l'arrivo di un vaccino contro la variante Omicron-1. Ma le riflessioni che nascono dal procedere delle autorizzazioni regolatorie prendono spunto più dalle incertezze che dalle prove scientifiche, e ancora non sappiamo quali altre strategie preventive saranno messe in campo per il prossimo autunno. Per quanto abbiamo imparato dall'inizio della pandemia, insomma, la risposta in termini di sanità pubblica è simile a quella pre-pandemica: staremo a vedere che cosa succede in autunno.
A due anni e mezzo dall’inizio della pandemia, ci troviamo in questi giorni a discutere se sia finita e se siamo approdati, finalmente, in condizione di endemia. Si disquisisce accademicamente sull’andamento del R0 sopra o sotto il valore di 1, ma la vita quotidiana è ancora lontana dalla normalità del convivere senza paure e in condizioni difensive attive, efficaci e condivise da tutti. E infatti c’è anche chi parla ormai esplicitamente di nuova ondata, estiva questa volta. Disponiamo di vaccini sicuri ed efficaci nel breve periodo dalla somministrazione per una infezione che non è stagionale come l’influenza, ma con picchi di contagio associati alla diffusibilità delle varianti del virus. A tutt’oggi non è stato condotto nessun trial comparativo tra i 28 vaccini utilizzati nel mondo. I criteri di scelta sono stati sinora quelli della opportunità di produrli, di acquistarli, di riceverli gratuitamente nell’ambito di accordi politici.
Meno del 14% delle persone che vivono in paesi a basso reddito ha avuto accesso ad almeno una somministrazione di vaccino; soprattutto, solo un operatore sanitario su quattro nei paesi africani più poveri ha completato la vaccinazione, come ci ricordano Guido Forni e Alberto Mantovani del rapporto recentemente realizzato per l’Accademia dei Lincei. Il che, come sappiamo, lascia ampie possibilità che si selezionino nuove varianti di SARS-CoV-2.
Lo stato immunologico della popolazione contro Covid-19 è complesso perché costituito in maggioranza dai vaccinati contro il virus iniziale (Wuhan), da alcuni vaccinati con i nuovi vaccini, da altri che hanno acquisito un’immunità dalla malattia causata dalle varianti Delta e Omicron. In un momento in cui la variante Omicron 5 rappresenta la causa principale delle nuove infezioni, in Italia solo il 40% degli immunocompromessi e il 19,2% degli anziani ultraottantenni ha ricevuto la seconda dose booster (la cosiddetta quarta dose) come indicato dal Ministero della Salute. Booster fatto, peraltro, con i vaccini disegnati sul virus di Wuhan e quindi con un risultato di protezione incerto.
Ci si interroga se stimolare la risposta immunitaria nei confronti di un virus ormai non più circolante non possa pregiudicare l’efficacia di un futuro, atteso, vaccino adattato nei confronti di Omicron. Infatti, immunizzando con varianti di un antigene già conosciuto in precedenza dal sistema immunitario è possibile che si inducano preferenzialmente risposte contro l’antigene originale (il cosiddetto “peccato originale antigenico”).
Tutte riflessioni che si affollano di fronte al procedere comunque delle autorizzazioni regolatorie (quelle recenti per i due vaccini mRNA a partire dai 6 mesi d’età e il nuovo Valneva con virus inattivato). Riflessioni che prendono spunto più che dalle evidenze, dalle perplessità, dovendo prendere atto che i criteri decisionali, inizialmente dettati dallo stato di emergenza, permangono tuttora immutati.
A quale strategia comunitaria si pensa? E perché? Dovrebbe essere chiarito, in modo appropriato ed efficace, e comunicato alla popolazione (quel processo di comunicazione come partecipazione alla conoscenza e alle decisioni che non è mai stato attivato).
Evidenze deboli per le vaccinazioni pediatriche
In questo scenario di incertezze, il 17 giugno scorso l’americana Food and Drug Administration (FDA) ha autorizzato l’estensione negli Stati Uniti dell’uso dei vaccini mRNA ai bambini di età compresa tra 6 mesi e 5 anni e il giorno successivo i Centers for Disease Control (CDC) hanno raccomandato l’uso di questi vaccini anche ai bambini con una precedente infezione da SARS-CoV-2. È verosimile che a breve anche l’Agenzia europea dei medicinali si esprimerà al riguardo, quanto meno per il vaccino prodotto da Moderna, per cui è già stato annunciato l’inizio della valutazione lo scorso 10 maggio.
In alcune nazioni la vaccinazione dei bambini più piccoli, con vaccini proteici, è già in atto da alcuni mesi: per esempio a Cuba con il suo vaccino Soberana 02 a partire dai 2 anni di età. Le decisioni regolatorie sono state accolte con entusiasmo e inviti a vaccinare tutti i bambini da parte degli expert leader della comunicazione nostrana. Eppure alcune considerazioni sono necessarie per questa classe della popolazione già esposta a un intenso calendario vaccinale nei primi due anni di vita, con dieci vaccini obbligatori e cinque raccomandati, per un totale di 7-8 sedute vaccinali. Una realtà che impone una programmazione chiara ed esplicita, per gli operatori come per le famiglie, affinché non si riduca la copertura vaccinale complessiva.
Innanzitutto occorre considerare che i due vaccini prevedono schemi di somministrazioni differenti: quello di Pfizer prevede due dosi contenenti 3 microgrammi di mRNA (un decimo del dosaggio somministrato all’adulto) a distanza di tre settimane e una terza dose a distanza di almeno due mesi dalla seconda. Il vaccino di Moderna sarà, invece, somministrato in due dosi di 25 microgrammi di mRNA (1/4 del dosaggio per l’adulto) a distanza di quattro settimane.
Le evidenze disponibili per questi due vaccini appaiono al momento piuttosto deboli. Nella tabella abbiamo riepilogato i risultati di efficacia e sicurezza per entrambi i vaccini.
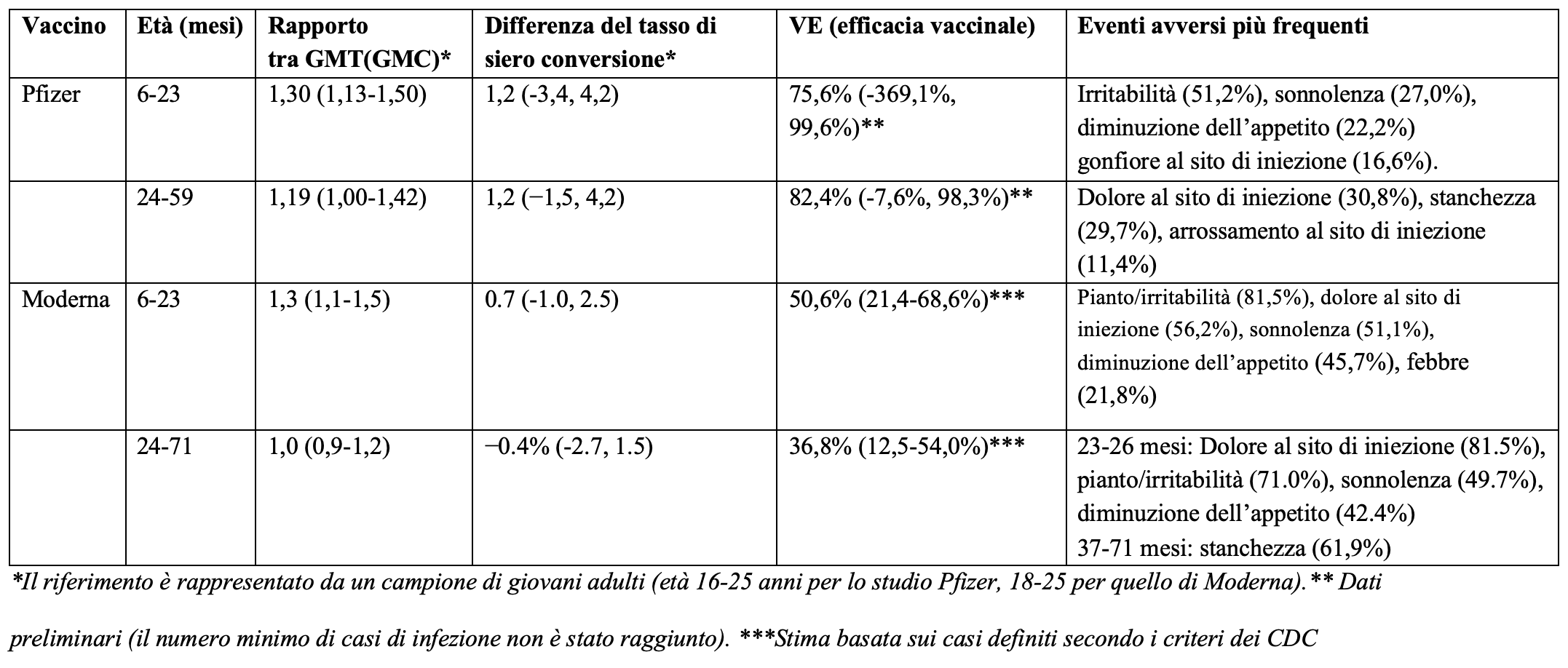
Gli studi presentati dalle due aziende nella richiesta di autorizzazione avevano come obiettivo primario quello di dimostrare che l’immunogenicità nelle due fasce 6-23 mesi e 2-5 anni era paragonabile e non inferiore a quella osservata nei giovani adulti dopo il ciclo primario con due dosi. In particolare, sono stati utilizzati come indicatori la media geometrica del titolo - o della concentrazione nel caso di Moderna - degli anticorpi neutralizzanti (GMT, GMC) e il tasso di sieroconversione.
Per entrambi i vaccini l’obiettivo primario è stato raggiunto, anche se per Pfizer è stato necessario introdurre un emendamento allo studio e prevedere la somministrazione di una terza dose. La capacità neutralizzante, però, è stata valutata verso il ceppo di riferimento USA_WA1/2020, vale a dire la variante originaria di SARS-CoV-2. Questo significa che sulla base della risposta immunitaria ci si potrebbe attendere un’efficacia vaccinale simile a quella osservata nei giovani adulti nei confronti del ceppo Wuhan (94-95%). È però altrettanto verosimile che l’efficacia nei confronti di Omicron sia inferiore, come del resto documentato dagli studi osservazionali riguardanti l’età pediatrica: in uno di questi l’efficacia vaccinale 2-4 settimane dopo la seconda dose del vaccino BNT162b2 (Pfizer) nei bambini di età 6-11 anni e negli adolescenti è risultata del 60%. Tuttavia, due mesi dopo la seconda dose l’efficacia vaccinale era sensibilmente diminuita a 29% nei bambini e 17% negli adolescenti. Per queste fasce di età nei trial originali l’efficacia vaccinale era rispettivamente 91% e100%.
E nei bambini di meno di cinque anni? Per quanto riguarda lo studio condotto da Pfizer, la bassa numerosità del campione che ha ricevuto la terza dose non consente di stimare l’efficacia vaccinale (non è stato raggiunto il numero minimo di 21 casi di infezione previsto nel protocollo). I dati preliminari basati sul numero di casi osservati oltre 7 giorni dopo la terza dose: 3 su 965 nel gruppo vaccinato e 7 su 450 nel gruppo placebo, hanno stimato una efficacia vaccinale di 80%, ma con un intervallo di confidenza al 95% (la distribuzione di valori probabili) estremamente ampio: da 14% a 97%.
L’efficacia stratificata per fasce di età è risultata non significativa: nei partecipanti tra i 6 e i 23 mesi l’efficacia vaccinale era del 76% (intervallo di confidenza al 95%: -369%, 100%) e in quelli tra i 2 e i 4 anni dell’82% (intervallo di confidenza al 95%: -8%, 98%). Inoltre, c’è un’ampia variabilità nell’intervallo trascorso tra la seconda e la terza dose (42-245 giorni) e il tempo mediano di follow-up dopo quest’ultima era breve: 35 giorni nel caso del gruppo 6-23 mesi e 40 di quello 2-4 anni, cosa che non consente di valutare la durata dell’efficacia nel tempo.
Nel caso del vaccino di Moderna l’efficacia vaccinale (casi di infezione a partire dai14 giorni dopo la seconda dose) è risultata di 51% (intervallo di confidenza al 95%: 21-69%) nella fascia 6-23 mesi e 37% (intervallo di confidenza al 95%: 13-54%) nei bambini di età 2-5 anni. In entrambi i casi, le stime di efficacia vaccinale non sembrano rispettare i criteri stabiliti dalla stessa FDA per definire la soglia minima di efficacia per i vaccini anti Covid-19 e cioè stima puntuale da 50% e limite inferiore dell’intervallo di confidenza maggiore del 30%.
Quella stimata nei confronti della variante Omicron, nei bambini come negli adulti, è un’efficacia per certi aspetti paragonabile a quella del vaccino antinfluenzale, con il limite che a questo ultimo è richiesto di garantire una protezione per alcune settimane, mentre nel caso di Covid-19 dovrebbe essere di qualche mese, meglio ancora se di almeno un anno.
Domande che non hanno risposta
Sono molti i quesiti che al momento non trovano risposta sulla vaccinazione anti Covid-19 nei bambini in età prescolare:
- Qual è la durata della protezione offerta dal vaccino? Come si può rispondere a questa domanda se nel caso dello studio di Moderna l’osservazione dopo la somministrazione si è protratta per solo 68 giorni e ancora meno (40 giorni) nel caso del vaccino Pfizer?
- Qual è l’efficacia nei confronti delle forme gravi di malattia? Come si può rispondere se nello studio sul vaccino Pfizer si è verificato un solo caso grave di Covid-19 e nessuno negli studi sul vaccino Moderna? Si può ipotizzare che, coerentemente con quanto osservato nelle altre fasce di età, la protezione sia elevata e duratura, ma non ci sono evidenze a supporto di questa ipotesi.
- La somministrazione dei vaccini nei bambini sotto i 5 anni avverrà durante la circolazione di nuove sottovarianti (BA.4 e BA.5). Considerando la bassa efficacia contro le prime sottovarianti di Omicron, quale potrebbe essere la protezione offerta nei confronti di quelle attualmente circolanti?
- Dal momento che non è possibile confrontare direttamente l’efficacia dei due vaccini, con quali criteri dovrebbero essere offerti, considerando le differenze nello schema di somministrazione: tre dosi in un caso, due nell’altro, diverso dosaggio dell’RNA messaggero, maggiore reattogenicità del vaccino Moderna? Quali informazioni fornire ai genitori per consentire una scelta consapevole?
- Di fronte alle evidenze limitate e alle incertezze, qual è il razionale di raccomandare la vaccinazione a tutti i bambini di età compresa tra 6 mesi e 5 anni in considerazione del mutato e mutevole quadro epidemiologico?
- Più in generale, è accettabile che le agenzie regolatorie, in un contesto epidemiologico già variato, si limitino a considerare come misura di efficacia la dimostrazione di una risposta immunitaria non inferiore nei confronti di un ceppo virale soppiantato da altre varianti?
- Quali potranno essere le decisioni dell’Agenzia europea dei medicinali dal momento che i dati sulla (modesta) efficacia vaccinale raccolti negli studi pre-autorizzazione saranno presto superati?
Ci penseremo in autunno?
In autunno è previsto l’arrivo di vaccini adattati alle nuove varianti, nello specifico alla variante Omicron-1, di cui la Food and Drug Administration ha autorizzato l’uso. Anche per questi vaccini ci sono molte incertezze e domande irrisolte: stando ai dati diffusi dalle aziende i livelli di anticorpi neutralizzanti contro Omicron-1 sono due volte più elevati con i richiami adattati rispetto a quelli ottenuti con i “vecchi” vaccini. Mancano, però, dati su come questo aumento di anticorpi neutralizzanti si traduca in termini di prevenzione dell’infezione, riduzione della circolazione del virus, impatto in termini di ricoveri ospedalieri e di morti evitati.
Il numero e le forme delle varianti, la risposta immunologica in termini di intensità e durata temporale, i mesi necessari per testare nuove componenti vaccinali, oltre ai costi economici rendono difficili previsioni circa l’efficacia basata su evidenze dei nuovi booster nel prevenire l’infezione e la trasmissione del virus.
In ogni caso, dobbiamo prendere atto che non si conoscono ancora (anzi non se ne sente proprio parlare) le strategie riguardo un’ulteriore dose di richiamo: sarà raccomandata per tutti, anche per adolescenti e bambini? Ma avere la disponibilità di un vaccino, che si tratti di adulti o bambini, è solo un aspetto della prevenzione. Quali strategie sono previste per informare e convincere alla vaccinazione le fasce di popolazione particolarmente vulnerabili tuttora ampiamente non vaccinate? Infine, al di là della vaccinazione, quali interventi si prospettano per il prossimo autunno per ridurre il rischio di contagio nelle aule scolastiche, sui mezzi di trasporto pubblico, nei luoghi di aggregazione?
Sono trascorsi cinque semestri dall’inizio della pandemia, molto si è fatto e molto si è appreso dei comportamenti difensivi sia del virus sia della popolazione, eppure la risposta in termini di sanità pubblica è simile a quella pre-pandemica: staremo a vedere che cosa succede in autunno. Nel frattempo tutti al mare.