Da diverso tempo del “buco dell’ozono” nella stratosfera antartica non se ne parla più, come se il protocollo di Montreal, sulla messa al bando delle emissioni di composti contenenti cloro (CFC e simili), avesse ottenuto un successo definitivo, scongiurando questa catastrofe ambientale.
In realtà, a parte un recupero a cavallo del 2000, la concentrazione dell’ozono stratosferico alla fine di settembre sull’Antartide ha ripreso a diminuire ogni anno, scendendo al di sotto delle 210 Unità Dobson (DU) al 26 settembre 2010 (nei primi anni ’80 era superiore a 360 DU), con un deficit di 150 DU. Le unità DU esprimono in millimetri di altezza “colonnare” la concentrazione di tutto l’ozono stratosferico che insiste su di una determinata superficie riportato a in condizioni standard.
Negli stessi anni, al termine dell’inverno boreale a marzo, i valori sull’Artide variavano tra 420 nel 1980 e 360 DU tra il 1995 e il 2008.
Il recente buco di ozono sul Polo Nord
In realtà nella primavera del 2011 si è registrato la formazione di un secondo “buco dell’ozono” nella stratosfera questa volta artica, paragonabile per estensione e profondità a quello individuato negli anni ’80 sul Polo Sud. L’allarme si è attivato perché lo strato di ozono stratosferico non si è riformato più con la stagione primaverile boreale ed è rimasta per alcuni mesi una pericolosa sacca di assenza, che ha interessato tutte le isole del Nord canadese e la Groenlandia settentrionale, fino alle coste del Canada settentrionale, della Siberia e dei Paesi Scandinavi.
Inoltre un pericoloso aumento della radiazione UV è stata registrata in queste aree ai primi di aprile, colpendo in misura minore, man mano che ci si muoveva verso Sud tutti i Paesi dell’Europa settentrionale fino ad essere registrata anche dall’Istituto di Scienze dell’atmosfera e del clima del CNR di Bologna.
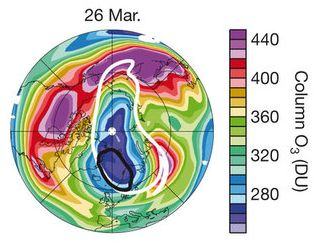
Figura 1 – La
concentrazione colonnare dell’ozono sull’Artide al 26 marzo 2011.
La danza dell’ozono
Ridiscutiamo rapidamente la storia dell’ozono. Questo gas si forma nella stratosfera (tra 15 e 50 km di altezza) per azione dei raggi ultravioletti (UV) più energetici, che spaccano le molecole biatomiche dell’ossigeno in due atomi eccitati separati, che aggrediscono altre molecole di O2 trasformandole in O3 triatomico.
O2 + hn(λ< 242 nm) ® O(3P) + O(1D)
O(1D) + O2 ® O3
(le notazioni usate indicano gli stati eccitati che gli atomi di ossigeno, provenienti dalla reazione precedente, assumono, dato il surplus di energia a disposizione e la mancanza di dispersione energetica nel corso del processo). Si noti che i due atomi diversamente eccitati non possono riformare direttamente l’ossigeno molecolare per motivi quantistici e che solo il più energetico O(1D) può aggredire l’ O2.
L’ozono a sua volta può essere scisso in O2 e O da altri raggi UV meno energetici.
O3 + hn (λ <340 nm) ® O2 + O
inoltre
O(1D) + O3 ® 2 O2
O(3P) + O3 ® 2 O2
Si stabilisce quindi un “equilibrio oscillante”, una danza, tra giorno e notte con formazione prevalente di O3 di giorno e sua diminuzione di notte a causa anche di reazioni chimiche parassite. Il fenomeno della diminuzione invernale dell’ozono e della sua riformazione nei periodi estivi interessa tutta la stratosfera terrestre, a stagioni ovviamente alternate, ed è più accentuato al di là dei circoli polari per le durate delle rispettive notti di buio. La circolazione atmosferica in quota tende a uniformare la distribuzione dell’ ozono tra i due emisferi, tranne che nell'atmosfera al di sopra dell'Antartide, dove la circolazione rimane chiusa e vi è poco scambio con l'aria proveniente dalle latitudine minori (Figura 2). Almeno questa era la spiegazione principalmente accettata circa l’assenza dello stesso fenomeno nella stratosfera del Polo Nord.
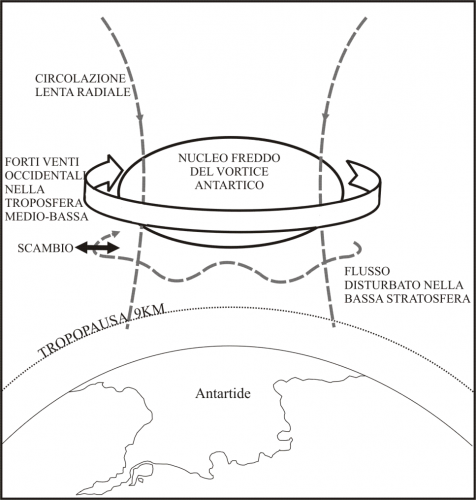
Figura 2. Il Vortice antartico.
L’assottigliamento delle tenue coltre di ozono stratosferico è importante, perché l'ozono assorbe gran parte della radiazione ultravioletta più nociva per gli esseri viventi (tale radiazione altera o distrugge il DNA e provoca tumori della pelle negli esseri umani), tanto è vero che la vita ha potuto svilupparsi al di fuori degli oceani soltanto dopo la trasformazione dell’atmosfera primitiva, da anossica ad ossigenata, promossa dall’attività delle alghe e delle piante fotosintetiche e dalla conseguente formazione di uno strato di ozono.
L’allarme per la formazione del buco dell’ozono
Alla metà degli anni ’80, con la presenza di stazioni scientifiche in Antartide e con l’uso dei satelliti (Figura 3), si scatenò l’allarme nella comunità scientifica perché lo strato di ozono stratosferico non
si riformava più con la stagione estiva australe e rimaneva una pericolosa sacca di assenza che si estendeva anche al di là dei margini del continente.
La colpa fu subito attribuita alla presenza, riscontrata sperimentalmente nei ghiacci di formazione recente, di composti sintetici, tra i quali i CFC (clorofluorocarburi). Infatti il legame cloro-carbonio presente in questi derivati sintetici del metano e dell’etano si rompe per azione dei raggi UV solari.
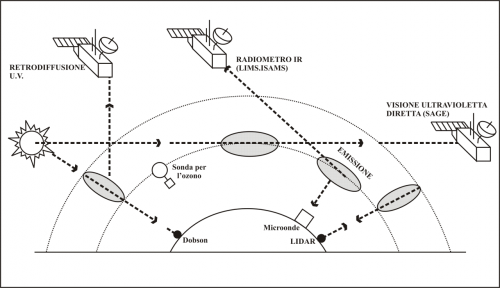
Figura 3. Le indagini sull’ozono
stratosferico in Antartide: in grigio i volumi di atmosfera che le varie
metodologie possono esplorare.
Questi sono coinvolti in un ciclo di reazioni fotochimiche e chimiche che, durante la stagione fredda, trasformano la molecola di ozono in ossigeno biatomico, alterando il ciclo naturale. Ad esempio il Freon-112:
CF2Cl2 + hn → Cl + CF2Cl° (radicale)
Cl + O3 → ClO + O2
ClO + O → Cl + O2
Ciò era stato previsto già dagli studi sulla chimica dell’atmosfera da
parte di Molina e Rowland (cui in seguito fu conferito il premio Nobel assieme
a Crutzen) che avevano mostrato che gli atomi di cloro sono catalizzatori molto efficienti per
la decomposizione delle molecole di ozono. In questo processo, complessivamente,
una molecola di ozono (O3) e un atomo di ossigeno (O) vengono
convertiti in due molecole di ossigeno (O2):
poiché l'atomo di cloro viene rigenerato alla
fine del processo, pochi atomi di cloro sono in grado, come tutti i
catalizzatori, di distruggere anche 1000 molecole di ozono (il processo ha
termine quando due atomi di cloro si combinano per dare la molecola Cl2).
Queste reazioni non solo distruggono l'ozono, ma impediscono anche che esso si
formi. Infatti gli atomi di ossigeno eccitati più energetici O(1D), avendo perso per
urti parte dell’energia, decadono a O(3P) inefficace. Inoltre entrambi sono catturati dalle molecole di
ClO formando ClO2 e queste ultime possono legarsi agli ossidi di
azoto, prodotti dagli scarichi degli aerei in alta quota e depositarsi sui
cristallini di ghiaccio delle nubi antartiche.
I CFC sono gas possono sfuggire ai compressori dei frigoriferi e dei condizionatori, o venivano emessi dalle bombolette spray o sono tuttora in uso nell’industria dell’elettronica: Essi pur essendo relativamente pesanti, riescono a giungere in alta quota in quanto non reagiscono con l’atmosfera e non sono solubili nelle piogge. In realtà nel ciclo naturale sono coinvolti altri composti clorurati come l’acido cloridrico anidro (HCl) di origine vulcanica o sostanze contenenti bromo emesse dalle alghe. Infine nella formazione del “buco” antartico giocano altri meccanismi, in cui intervengono gli ossidi di azoto, a suo tempo tra i primi sospettati, e la formazione di nubi stratosferiche che li assorbono insieme al ClO e li restituiscono con il riscaldamento primaverile.
Questa scoperta portò a bandire l'uso dei CFC in molti paesi e ha indirizzato le ricerche e la sperimentazione verso nuovi tipi di gas. Fu possibile giungere abbastanza rapidamente al Protocollo di Montreal (1987) e ai successivi Trattati operativi, perché le grandi multinazionali avevano già pronta la tecnologia alternativa per la produzione degli idroclorofluorocarburi HCFC (a vita relativamente breve in atmosfera), degli idrofluorocarburi (HFC) e dei fluorocarburi (FC) entrambi privi di cloro. Questi ultimi due però hanno vite medie di migliaia di anni e si stanno accumulando nell’atmosfera contribuendo al riscaldamento globale in atto.
La situazione era ben diversa quindi dall’attuale battaglia politica ed economica contro l’utilizzo dei combustibili fossili, responsabili del GW di origine antropica, nonchè dell’inquinamento urbano e transnazionale.
Il Protocollo di Montreal ebbe diverse opposizioni iniziali e non fu approvato fino al 1999 (accordo di Pechino) dai Paesi emergenti, come l’India, la Cina, l’Indonesia, che non avevano una tecnologia alternativa pronta e potevano solo comprare gli FC e gli HFC dalle multinazionali.
Prima nota: l’ozono troposferico come inquinante. Non dobbiamo comunque dimenticare la differente azione dell’ozono stratosferico (l’ozono “buono”) e di quella dell’ozono che si forma negli strati inferiori della troposfera, dove i raggi UV (310 < λ < 420 nm)che riescono a superare la fascia stratosferica e che sono molto meno pericolosi per la salute umano, sono comunque in grado di spezzare le molecole di NO2 prodotte nel traffico di qualsiasi tipo e in tutti i processi di combustione, specie ad alta temperatura. Questo ozono (“cattivo”) oltre ad essere leggermente irritante può essere dissociato da quei raggi U.V. che pervengono sulla superficie formando singoli atomi di ossigeno molto aggressivi; questi, reagendo con tutti gli altri composti volatili presenti nell’ aria inquinata, danno luogo ad una catena di reazioni chimiche e radicaliche con formazione di composti secondari tossici, mutageni e cancerogeni,
Seconda nota: la refrigerazione dei cibi: è un'operazione indispensabile per conservare gli alimenti e nutrire l'umanità; inoltre il condizionamento dell'aria condizionata necessario in situazioni particolari ed in certe regioni della Terra, si è diffuso in tutti i paesi industrializzati. Le apparecchiature usate per ottenere refrigerazione e aria condizionata contengono un gas che deve essere compresso e liquefatto, dopodichè lo si lascia espandere bruscamente a pressione ambiente (decompressione adiabatica, che provoca l’abbassamento di temperatura). L'aspetto chimico del problema riguarda il tipo di gas che deve essere usato, considerando anche il fatto che l'apparecchiatura che lo contiene può avere perdite, può rompersi e che, in ogni caso, ha una durata limitata. Un tempo nei frigoriferi si usava ammoniaca (NH3), o diossido di zolfo (anidride solforosa SO2), due gas tossici. Pertanto i chimici hanno ricercato nuove sostanze che potessero avere le caratteristiche fisiche richieste e che non mostrassero alcun effetto dannoso dal punto di vista biologico. Dopo una lunga ricerca, si giunse ai clorofluorocarburi, indicati dalla sigla CFC, il più noto dei quali è il Freon-112 (CF2Cl2). Essendo completamente innocui dal punto di vista biologico, i CFC vennero usati estesamente anche come propellenti nelle bombolette spray per vernici, creme da barba, lacche per capelli, etc.
Una strana coincidenza
Una strana coincidenza si è verificata nei giorni scorsi: uno dei satelliti UARS (Figura2) destinati allo studio dell’ozono stratosferico e operante dal 1991 al 2005 lungo un’orbita inclinata a 57 gradi e ad una quota di 604 km, ha esaurito il suo compito ed è diventato ingovernabile, costringendo la Stazione Spaziale il 26 ottobre 2010 ad eseguire manovre di emergenza per evitare collisioni; infine i detriti sono precipitati nell’oceano Pacifico (il 24 settembre del 2011), dopo un certo allarme in Italia settentrionale.

Figura 4 – Uno dei satelliti UARS (Upper Atmosphere Research Satellite)
(vedi lo schema di Figura 3) dedicati allo studio dell’alta atmosfera e
precipitato nell’Oceano Pacifico il 24 settembre 2011.
Come mai solo nel 2011 si è formato un buco di ozono anche sull’Artide?
Una prima spiegazione è legata all’aumento della temperatura invernale e primaverile della troposfera dell’Artico, il che comporta al contrario un raffreddamento degli strati stratosferici sovrastanti per mantenere il bilancio radiativo. Inoltre ai Poli l’intera atmosfera si schiaccia a causa della rotazione terrestre e la troposfera è confinata entro i 7-8 km contro i 14-15 km delle nostre latitudini. Le nubi più alte, ricche dell’umidità accumulata durante l’estate, possono quindi penetrare negli strati più freddi della stratosfera con la formazione di minuti e diffusi cristallini di ghiaccio, che restano in sospensione per la scarsa vorticosità verticale. Su questi cristallini si depositano sia il monossido di cloro ClO (un intermedio importante del ciclo dell’ozono) che i suoi composti di addizione con gli ossidi di azoto (ClONO2 e ClONO3), rilasciati in quota dagli scarichi degli aerei in rotta transpolare. Queste sostanze agiscono come un “corpo di fondo”, una riserva di sostanze “killer” dell’ozono, non appena il calore primaverile comincia a fondere i cristalli di ghiaccio. Questo meccanismo era stato già invocato anche per la distruzione dello strato di ozono antartico.
Buco dell’ozono e riscaldamento globale
L’ambiente è una serie di scatole cinesi, non una serie di comparti separati. Infatti mentre i CFC erano pericolosi principalmente per l’attacco allo strato di ozono, FC e HFC presentavano una insidia a lungo termine. Infatti i primi sono pressoché immortali: non vi è processo naturale che li distrugga. I secondi possono essere solo aggrediti dai rari radicali OH che ne possono asportare l’atomo di idrogeno, avviandone la distruzione per ossidazione in atmosfera: ma anche in questo caso la vita media è stata calcolata in centinaia di anni. E tutti questi composti, molto efficaci come effetto serra, contribuiranno lentamente al suo incremento ulteriore. Su questa base alcune aziende sensibili alla “green chemistry” e agli incentivi per la “green economy” si stanno infatti orientando ad utilizzare fluidi frigoriferi organici e non tossici, in grado di essere metabolizzati dai meccanismi atmosferici naturali, una volta dispersi nell’atmosfera stessa.
D’altra parte l’industria produce e utilizza anche molti altri solventi e composti chimici contenenti cloro o bromo, ma tutti questi sono liquidi o solidi poco volatili e molto pesanti: la loro pericolosità per la salute è però legata alla diffusione nell’ambiente attraverso la dispersione come aerosol o per l’inquinamento delle acque
Conclusioni
La vicenda del "buco dell'ozono" ci insegna molte cose:
A)
che il
problema delle sostanze chimiche di origine antropica che agiscono da killer
dell’ozono è stato ampiamente sottovalutato;
B)
che il tempo
necessario ad attuare il Trattato di Montreal si è prolungato per la resistenza
degli Stati con economie emergenti ad applicarlo e che la valutazione che
l’effetto dei gas clorurati sarebbe stato metabolizzato dall’atmosfera nel giro
di 30-35 anni fu sottostimato;
C)
oppure ancora
che gli effetti cumulativi delle emissioni naturali (HCl di origine vulcanica,
composti bromurati emessi dalle alghe, etc.) hanno subito una accelerazione che
non ha bilanciato la lenta spontanea distruzione dei composti di origine
antropica ad opera dei normali processi atmosferici;
D) infine che
le sostanze chimiche, a differenza degli uomini, vanno considerate colpevoli
finché la loro innocenza non è provata; l’industria non può interviene mano a
mano che i problemi si presentano il che richiede tempo e investimenti per
approntare nuove tecnologie sostitutive. Nel caso dei CFC si è trattato solo di
convertirne la produzione in quella di HFC e FC, tecnologia già pronta per
altri scopi industriali. È chiaro che la cosa importante è estendere il più
possibile, preventivamente, le conoscenze sulle conseguenze sulla salute umana
e sull’ambiente prima di immettere nell’ambiente stesso i prodotti di qualsiasi
nuova produzione di massa.
Riferimenti:
G.L. Manney et al., Nature 2/10/2011, doi: 10.1038/nature
10556;
M.J. Molina, F.S. Rowland, Nature
1974;
“Scientific
Assessment of Ozone Depletion: 2010”
– Executive Summary of WMO/UNEP, 2010.



