
I macrofagi infettati da HIV, l'identificazione delle cellule che "nascondono" il virus in forma latente, la terapia genica per eradicare l'infezione: questi i principali temi presentati al convegno internazionale su HIV che si tiene a Miami ogni due anni.
Nell'immagine: una cellula T infettata da HIV. Crediti: NIAID/Flickr. Licenza: CC BY 2.0
Sintesi
Anche se la terapia antiretrovirale di combinazione (cART) ha una grande efficacia, per trovare farmaci che eradichino definitivamente o funzionalmente il virus HIV si devono prima capire i dettagli molecolari dell’infezione e della sua interazione con il sistema immunitario. Decifrare il ruolo dei macrofagi e dei loro precursori è essenziale nella lotta contro i virus, come abbiamo imparato in questi ultimi mesi. Fortunatamente, la ricerca su HIV è ancora vivace, anche se i suoi finanziamenti diminuiscono di pari passo con la risonanza pubblica dell’argomento, nonostante che ogni anno aumenti il numero di nuove infezioni; ogni due anni, la comunità scientifica si dà appuntamento a Miami per fare il punto della situazione.
La cART non riesce a stanare il virus dalle cellule nel cui genoma si è integrato, ancora infettivo; quando la terapia viene sospesa, il virus torna a replicarsi, rendendo il suo ospite in grado di trasmettere ad altri l’infezione per via sessuale, ematica, o con l’allattamento al seno. Possono fungere da serbatoio non solo i linfociti CD4+, ma anche i macrofagi, che vengono infettati con il legame del virus a recettori situati sulla membrana cellulare: sofisticate tecniche di imaging con virus fluorescente hanno dimostrato, nei macachi, che, quando viene sospesa la terapia, l'infezione riparte in cellule mieloidi precursori dei macrofagi presenti nell'intestino crasso o circolanti nel sangue, che esprimono in superficie la molecola NCAM (nerual cell adhesion molecule), al pari dei neuroni, della glia e delle cellule muscolari scheletriche. L'infezione dei macrofagi, infatti, ha un ruolo particolare nel danneggiare il sistema nervoso centrale. Inoltre, essa nasconde il virus ad anticorpi e farmaci.
Uno dei meccanismi di persistenza dell’infezione virale è legato all’integrazione del virus nel genoma cellulare; oggi è possibile non solo usare il sito d’integrazione virale nel genoma cellulare come marcatore specifico dell’infezione, ma anche stabilire se queste cellule siano in grado di espandersi. Il meccanismo con cui lo fanno pare essere la stimolazione antigenica da parte di agenti infettivi comuni e diffusi all’interno della popolazione sieropositiva.
Gli sforzi dei ricercatori sono indirizzati a una terapia genica che miri a bloccare la produzione di nuove particelle virali infettanti senza eliminare completamente dall’organismo le cellule in cui sono nascoste: si opera per sviluppo di terapie one-shot, che impediscano per molti mesi la ricomparsa del virus con un’unica somministrazione, in sostituzione della terapia quotidiana. (Simonetta Pagliani)
Introduzione
Ogni due anni, la comunità scientifica impegnata nella ricerca di una cura per HIV, ovvero per eradicare l’infezione, si ritrova a Miami per fare il punto della situazione. Negli ultimi anni, il concetto di cura è stato declinato in quello di “cura funzionale”, ossia l'abbassamento del numero di cellule infettate con virus al di sotto della soglia necessaria a riaccenderne la replicazione quando si sospende la terapia antiretrovirale di combinazione (cART) o in “remissione a lungo termine” (in assenza di cART). È infatti acquisito che, nonostante la sua potenza ed efficacia, la cART non intacchi i serbatoi (reservoir) di cellule portatrici che nascondono il virus, integrato nel loro genoma ma ancora infettivo. Quando la terapia viene sospesa, il virus inizia nuovamente a replicarsi, rendendo la persona in grado di trasmettere ad altri l’infezione per via sessuale, mediante scambio di sangue o emoderivati contaminati, o con l’allattamento al seno.
La novità di fondo dell'ultimo meeting di Miami del dicembre scorso è stato il “rinascimento” di un concetto meno esclusivo di serbatoio (reservoir) in cui non solo i linfociti CD4+, ma anche i macrofagi (cellule del sistema immunitario presenti in diversi tessuti dell'organismo) sono infettate da virus. Si ripropone quindi il tema dell’eterogeneità dei serbatoi virali resistenti alla terapia. L’infezione dei macrofagi avviene, come per i linfociti T, con il legame del virus alla molecola CD4 e un co-recettore (prevalentemente CCR5), entrambi presenti sulla membrana cellulare.
L'infezione dei macrofagi ha però alcune caratteristiche particolari, tra cui:
- è fondamentale nell’infezione nel sistema nervoso centrale, a causa della quale, in assenza di terapia, il paziente può andare incontro a un’encefalite mortale (unico caso di letalità diretta da HIV)
- i macrofagi non muoiono come conseguenza dell’infezione (risultati in vitro), né vanno incontro a diminuzione (risultati in vivo)
- si fa strada l’ipotesi che i macrofagi rappresentino dei “cavalli di Troia” del virus, nascondendolo ad anticorpi e farmaci che hanno difficoltà di accesso a questi compartimenti
L'infezione riparte nei macrofagi
Una sperimentazione sui macachi ha mostrato che quando viene sospesa la terapia l'infezione riparte nei precursori dei macrofagi nell'intestino. Un altro studio ha osservato l'infezione da parte di HIV in un altro tipo di precursore dei macrofagi circolante nel sangue
Partendo da queste conoscenze ben consolidate da tempo, Tom Hope (Department of Cell and Molecular Biology, Feinberg School of Medicine, Northwestern University, Chicago, ha presentato prove in un modello sperimentale di macachi infettati col virus SIVmac239 a sostegno di un ruolo centrale dei macrofagi tissutali nel fenomeno di rebound (rimbalzo) della viremia alla sospensione della cART. Applicando sofisticate tecniche di imaging e un virus fluorescente, Hope ha osservato che la principale sede anatomica di rebound è l’intestino crasso (cieco, colon e retto), osservazione in linea con precedenti studi. La novità di questo studio è stata che la fonte cellulare di virus “rimbalzante” non erano i linfociti T CD4+, bensì cellule mieloidi (precursori dei macrofagi e di altre cellule del sangue) che esprimono in superficie la molecola CD56 (nerual cell adhesion molecule), la cui precisa definizione è in corso.
Sulla stessa lunghezza d’onda, Brooks I. Mitchell (John A. Burns School of Medicine, University of Hawaii, Honolulu) ha descritto la messa a punto di una versione modificata di saggio per quantificare i serbatoi circolanti di virus infettante. Modificando il test definito “TZA”, disegnato per poter misurare l’infezione dei linfociti T CD4+, al fine di verificare la potenziale infezione dei monociti (una forma di macrofagi) circolanti, Mitchell si è avvalso della coorte hawaiana H032, nella quale ha osservato l’infezione di queste cellule in alcuni individui. Le cellule infettate appartenevano a un piccolo gruppo definito dal marcatore di superficie CD16, le cui cellule esprimono anche i più alti livelli di CD4, CCR5 e CXCR4. Una caratteristica particolare di queste cellule è la capacità di entrare e uscire dai tessuti, come fanno i linfociti, mentre per la maggioranza dei monociti il viaggio è a senso unico, perché una volta entrati in un tessuto in risposta a segnali chemiotattici vanno incontro a un processo differenziativo che li àncora al tessuto stesso. Infine, Mitchell ha riportato che questo sottoinsiemi di monociti infettati era particolarmente frequente nei pazienti con segni di compromissione neurocognitiva nonostante l’efficacia della cART.
Quando il virus si nasconde
Studi condotti nei macachi hanno mostrato che la diminuzione dei linfociti T associata alla somministrazione di un particolare gruppo di molecole determina il rialzo della viremia anche se si continua la terapia farmacologica: potrebbe essere un approccio promettente per "stanare" i virus latenti. Tre diversi lavori hanno poi indagato il meccanismo di proliferazione delle cellule in cui si nasconde il virus, mentre una ricerca ha evidenziato la loro presenza in diverse sedi anatomiche
Maud Mavigner (Emory University School of Medicine, Atlanta), del gruppo guidato da Guido Silvestri, ha presentato dati interessanti sulla modulazione farmacologica del rimbalzo (rebound) virale indotto dalla diminuzione di cellule CD8+ (linfociti T, cellule NK) in macachi trattati con cART. I ricercatori si sono focalizzati su farmaci in grado di attivare il fattore trascrizionale cellulare NF-kB, molecola chiave del processo infiammatorio. Al riguardo, la molecola nota come Ingenol era già nota per la sua efficacia sperimentale in studi in vitro ed ex vivo di riattivazione di virus dormienti. La novità presentata al congresso è stata di aver studiato un altro gruppo di molecole, definiti mimetici delle SMAC (second mitochondrial activator of caspases), in grado di attivare la cosiddetta via non canonica di attivazione di NF-kB, indotta fisiologicamente da ligandi diversi da quelli in grado di attivare la via canonica e con caratteristiche diverse (Figura 1).

Nonostante il mantenimento della cART, la totalità degli animali infettati in cui alla deplezione delle cellule CD8+ è stata associata la somministrazione di un mimetico SMAC ha dimostrato ripresa della viremia, mentre ciò è avvenuto solo in 5 macachi su 9 se non era associata la deplezione cellulare. Nonostante questi macroscopici effetti, non si sono osservate variazioni significative dei livelli di cellule infettate con virus infettivo o dei livelli di DNA virale associato alle stesse cellule. Queste osservazioni sono state recentemente pubblicate su Nature in associazione a un altro studio rilevante dello stesso team di ricerca, in collaborazione con altri, sullo stesso tema.
Un limite fondamentale allo sviluppo di terapie efficaci nell’eradicare l’infezione virale è la mancanza di una conoscenza approfondita dei meccanismi molecolari che consentono alle cellule infettate di persistere negli individui trattati con cART. Al congresso sono state mostrate varie novità anche su questo aspetto, in particolare per i linfociti T CD4+, i bersagli principali dell’infezione. Da alcuni anni è noto che uno dei meccanismi di persistenza dell’infezione virale è legato alla proliferazione clonale di cellule T contenenti il virus integrato, generalmente in singola copia nel genoma cellulare. Poiché nel nostro codice genetico ci sono circa 3x109 possibili siti d’integrazione, è estremamente improbabile che due virus si integrino in due cellule diverse nella stessa posizione, e pertanto il sito d’integrazione virale nel genoma cellulare può essere usato come marcatore specifico per riconoscere nel tempo un linfocita T infettato sia a livello di sangue periferico che in organi e tessuti. Inoltre, grazie allo sviluppo di tecniche specifiche, oggi non solo è possibile identificare la posizione dei siti d’integrazione virale ma anche stabilire se queste cellule siano state in grado di proliferare ed espandersi.
Tre lavori presentati alla conferenza da Nicolas Chomont (Centre de recherche du CHUM and Department of Microbiology, Infectiology and Immunology, Université de Montréal, Montreal, QC, Canada), P. Gantner (Virology Laboratory, Hôpitaux Universitaires de Strasbourg, e Strasbourg University, INSERM) e Francesco Simonetti (Department of Medicine, Johns Hopkins University, Baltimore, MD, 21205, USA) hanno caratterizzato i meccanismi alla base della proliferazione ed espansione clonale di cellule T infettate. Sebbene i tre studi indipendentementi abbiano utilizzato approcci diversi, i loro risultati concordano sul fatto che il principale meccanismo di espansione e persistenza clonale dei linfociti sia la stimolazione antigenica mediata dal T Cell Receptor (TCR), ovvero dal complesso recettoriale deputato al riconoscimento di antigeni non self, da cui consegue la proliferazione e la risposta immunitaria dei linfociti T. Ogni linfocita T espone in superficie un TCR, ed è stato calcolato che il potenziale di repertorio di antigeni riconosciuti dai linfociti T umani sia nell’ordine della cifra astronomica di 1016. Studiando la specificità del TCR in cellule T isolate da pazienti infetti, questi ricercatori hanno identificato che molti dei cloni infetti ed espansi avevano stesso sito d’integrazione e stesso TCR che, in molti casi, risultava specifico per agenti infettivi comunemente presenti e diffusi all’interno della popolazione sieropositiva.
Sullo stesso tema Frank Maldarelli (HIV Dynamics and Replication Program, NCI, NIH, Frederick, MD, USA) sta studiando in organi e tessuti donati post-mortem, per il momento di 3 pazienti HIV-1+, la distribuzione dei cloni T CD4 infettati ed espansi clonalmente. Maldarelli ha osservato che le cellule infette e clonalmente espanse sono presenti in varie sedi anatomiche, tra cui polmoni e cervello, e perfino in aree interessate da lesioni tumorali metastatiche. A completamento di questi studi sarà importante definire quanti cloni cellulari contengono il genoma completo di HIV integrato, e non difettivo, in quanto solo i primi sono capaci di produrre nuove particelle virali infettanti in grado di trasmettere l’infezione ad altre persone e causare la progressione di malattia della persona infettata in caso di sospensione della cART.
Terapia genica contro HIV
Due lavori hanno presentato possibli approcci terapeutici per l'eradicazione del virus, l'uno usando linfociti T ingegnerizzati in grado di eliminare le cellule infette, l'altro promuovendo la produzione di una molecola in grado di bloccare le particelle virali circolanti. Un terzo studio, infine, è indirizzato alla possibilità di togliere dalle cellule la "porta d'accesso" per il virus
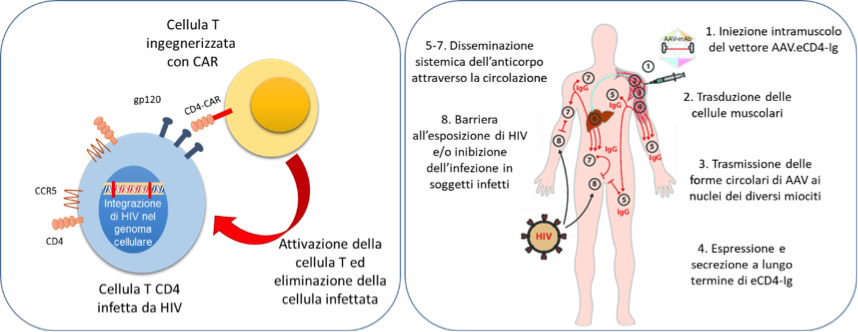
Grossa attenzione è stata dedicata anche ai nuovi approcci terapeutici mirati all'eradicazione e/o al controllo funzionale dell'espressione di HIV, ovvero in grado di bloccare la produzione di nuove particelle virali infettanti senza eliminare completamente dall’organismo le cellule che le hanno prodotte. Grazie ad approcci di terapia genica, alcuni studi mirano a potenziare l’attività dei linfociti T CD8+ del paziente rendendole in grado di uccidere in maniere più efficiente le cellule infette. I lavori di Chris W. Peterson e Hans-Peter Kiem (Fred Hutchinson Cancer Research Center, Seattle, WA, USA) e di K. Anthony-Gonda della Lentigen hanno mostrato come cellule T ingegnerizzate siano in grado di persistere a lungo nei diversi modelli animali adottati e siano anche in grado di eliminare le cellule infette riducendo l’entità e ritardando la ricomparsa del virus in seguito a sospensione della cART.
Matthew R. Gardner (Department of Infectious Diseases, The Scripps Research Institute, Jupiter, FL, USA), utilizzando un vettore adeno-associato, mira invece a promuovere la produzione da parte delle cellule muscolari di una molecola chimerica (eCD4-Ig) in grado di riconoscere le particelle virali circolanti e bloccarne la capacità infettiva legandosi sulla superficie (DOI: 10.1128/JVI.02011-17). Questo approccio si è dimostrato efficace sia nel proteggere dall’infezione virale macachi sani, che nel mantenere la soppressione virale in animali già infetti alla sospensione della cART.
Sebbene preliminari, questi dati aprono nuove speranze per lo sviluppo di approcci terapeutici definiti one-shot, ovvero che permettano tramite unica somministrazione di controllare e impedire per molti mesi la ricomparsa del virus, approcci molto richiesti da parte della comunità dei pazienti sieropositivi e che potenzialmente potrebbero sostituire la terapia a posologia giornaliera.
Su questa linea si colloca anche il progetto di Paula Cannon (Keck School of Medicine, University of Southern California, Los Angeles, CA, USA) che, utilizzando un approccio avanzato di ingegneria genetica noto come targeted genome editing, mira a eliminare dal genoma delle cellule T l’espressione del gene CCR5, che codifica per il co-recettore necessario assieme alla molecola CD4 per permettere l’ingresso del virus nella cellula, e, al tempo stesso, conferire loro la capacità di produrre la molecola chimerica (eCD4-Ig) prima descritta, per proteggere dall’infezione anche cellule T non modificate geneticamente e presenti nel paziente stesso (Figura 2).
Tanti quindi i progetti e i risultati proposti che sottolineano come la ricerca su HIV sia ancora viva e fertile, sebbene i finanziamenti a disposizione siano sempre più limitati e l’argomento abbia una risonanza e una sensibilità pubblica in calo pur a fronte di un incremento del numero di nuovi casi d’infezione ogni anno. Nonostante la cART abbia cambiato la vita delle persone sieropositive, tanto si può e si deve ancora fare per capire i dettagli molecolari dell’infezione e della sua interazione con il sistema immunitario per trovare terapie sempre più efficaci nell’eradicare definitivamente o funzionalmente il virus HIV. Appuntamento tra due anni a Miami, coronavirus permettendo!


