Donne e uomini sono diversi. Dal punto di vista scientifico l’affermazione può apparire banale, dato che le differenze tra femmine e maschi sono il punto centrale della riproduzione sessuale, cioè del sistema di maggiore successo prodotto dalla selezione naturale durante l’evoluzione di animali e piante: esseri umani inclusi. Ovviamente, le differenze psicologiche sono di grande importanza al momento della scelta del partner. Molti risultati scientifici indicano che l’attrazione, la bellezza e la ricompensa sono aspetti chiave nelle preferenze soggettive per i volti del sesso opposto. Però, sino a quando una nuova scienza neurocognitiva, la Neuroestetica, ha iniziato a fare chiarezza, ben poco si sapeva sulle differenze maschio/femmina nei meccanismi cerebrali che stanno alla base della percezione della bellezza.
La Neuroestetica nasce nel 2004, quando tre diversi studi hanno offerto i primi dati sulle aree del cervello che si attivano durante l’apprezzamento estetico (Cela-Conde et al, 2004; Kawabata & Zeki, 2004; Vartanian & Goel, 2004). Nessuno di questi studi aveva però controllato se, e quali, differenze esistevano tra l’attività cerebrale di maschi e femmine durante la percezione estetica. Cinque anni più tardi, Di Dio e Gallese (2009) hanno pubblicato uno studio sullo stato dell’arte della Neuroestetica, analizzando 29 articoli, nessuno dei quali faceva riferimento a differenze di genere nell’apprezzamento della bellezza: eccetto un nostro studio (Cela-Conde et al, 2009) che Di Dio e Gallese hanno definito “un lavoro pionieristico nell’esplorazione neurale delle differenze di genere nell’apprezzamento dell’arte. La magnetoencefalografia (MEG) ha permesso di esaminare i vari stadi temporali durante i quali vengono elaborati gli stimoli. Grazie a questa tecnica è stato possibile individuare dettagliatamente le differenze tra i due sessi nelle regioni parietali, discusse poi dagli autori da una prospettiva evoluzionistica”.
Prima di affrontare nel dettaglio lo studio, prendiamo in considerazione
anche una ricerca che Di Dio e Gallese (2009) non hanno menzionato, e che però
ha alcune relazioni con la percezione della bellezza. Schirillo (2007) ha compiuto
un esperimento sull’espressione di emozioni nei ritratti artistici di
Rembrandt. Nei dipinti dell’Europa occidentale nel periodo tra il 16° e il 20°
secolo, circa il 68% delle donne mostra il lato sinistro del volto, che è mostrato
soltanto dal 56% degli uomini.
Anche Rembrandt ha seguito questa regola; nel 64% dei suoi ritratti, le
donne mostrano infatti la guancia sinistra all’osservatore. Nel lavoro appena
citato Schirillo (2007) afferma che questa differenza tra uomini e donne è in
linea con l’idea che l’osservatore consideri le figure maschili che nei quadri
di Rembrandt mostrano la guancia sinistra, come qualcosa da evitare: il che può
riflettere il fatto che l’esibizione aggressiva dell’atteggiamento di “dominio”
sia regolata dall’emisfero controlaterale destro. Mentre il fatto che l’osservatore
invece consideri le figure femminili che mostrano la guancia sinistra come
qualcosa di gradevole, da avvicinare, può indicare attrazione sessuale. Tuttavia
Schirillo non aveva studiato nei suoi soggetti l’attività cerebrale, dato che
il suo studio era basato sul giudizio semantico. A questo punto ci si può
quindi chiedere se esistono differenze nell’attività cerebrale tra femmine e
maschi che osservano e valutano la bellezza degli oggetti.
Il nostro gruppo (Cela-Conde et al., 2009) ha confrontato l’attività
cerebrale di 10 donne e 10 uomini durante la valutazione estetica di stimoli
visuali, artistici e non artistici. Abbiamo usato la magnetoencefalografia
(MEG) che rileva le variazioni del campo magnetico generato dall’attività
postsinaptica dei neuroni con una risoluzione temporale di millisecondi.
Il punto di partenza era il tentativo di comprendere se le possibili
differenze tra i sessi siano legate a processi verificatisi durante
l’evoluzione della specie umana o di quella di un progenitore primate più
antico. Due erano le possibilità: se le differenze tra maschi e femmine
riguardano regioni del cervello relativamente conservate, è possibile che esse
siano un’eredità dei primati nostri progenitori. Se invece riguardano regioni
che sappiamo aver subito considerevoli cambiamenti dopo la divisione tra la
linea evolutiva degli scimpanzé e quella degli esseri umani, esse probabilmente
risalgono a processi evolutivi di rilevanza speciale per il tipo di vita
condotta dall’uomo.
Il nostro esperimento ha mostrato che l’apprezzamento estetico visuale
coinvolge un’attività cognitiva di alto livello, sia nelle donne che negli
uomini. In entrambi i sessi, la maggiore attività riguarda il lobo parietale: è
bilaterale nelle donne e lateralizzata all’emisfero destro negli uomini (Figura
1).
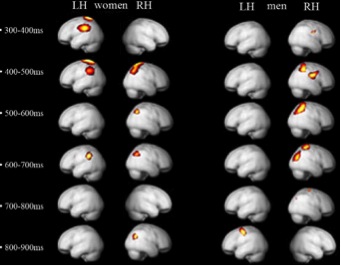
Attività
cerebrale provocata da stimoli estetici nell’uomo e nella donna (Cela-Conde et
al., 2009). La figura mostra aree cerebrali in cui l’attività è
significativamente maggiore (P0.001) in seguito a stimoli giudicati come belli,
anziché non belli da uomini e donne a differenti
intervalli temporali. I
dettagli tecnici si trovano in Cela-Conde et al. (2009)
Queste differenze nei correlati neurali dell’attività cognitiva suggeriscono
l’esistenza di strategie differenti di elaborazione dello stimolo estetico nelle
donne e negli uomini: che non sono però facili da chiarire. Noi abbiamo suggerito
che la maggiore lateralizzazione maschile può riflettere differenze nelle
strategie esplorative dei due sessi. Le donne esplorano relazioni spaziali di
tipo categorico (Van der Ham, et al., 2009), vale a dire più qualitative di
quelle che riguardano l’emisfero destro dei maschi, che usano invece una
strategia esplorativa di tipo coordinato (Van der Ham, et al., 2009), basata su
relazioni spaziali di tipo metrico preciso. Tuttavia sono possibili
interpretazioni diverse da quelle basate sulle strategie di esplorazione spaziale.
È generalmente accettato che la corteccia parietale destra sia associata
all’attenzione visuale globale, quella sinistra all’attenzione locale. Forse,
le donne usano sia gli aspetti globali che quelli locali durante la formulazione
del giudizio, mentre gli uomini si basano solo su fattori globali. E si è anche
ipotizzata una relazione fra le nostre osservazioni ed il linguaggio. Le donne
ottengono punteggi più elevati in una varietà di test verbali e di linguaggio
(Hide & Linn, 1988): forse sono più propense ad associare le immagini con
etichette verbali rispetto agli uomini, e producono quindi differenze nella
lateralizzazione dell’attività neurale. È un’ipotesi che però richiede
ulteriori verifiche sperimentali per essere presa seriamente in considerazione.
Anche se gli specifici processi cognitivi associati all'apprezzamento della bellezza sono ancora indeterminati, noi proponiamo una spiegazione delle caratteristiche evolutive della capacità di apprezzamento basata sulla selezione sessuale. Lo scenario più convincente è quello descritto dall’ipotesi “cacciatori-raccoglitori” di Silverman’s & Eals’s (1992) sulle differenze di genere nelle abilità spaziali. Le differenze tra uomini e donne nelle abilità spaziali sarebbero associate alla divisione del lavoro. Mentre l’uomo cacciava le prede, la donna raccoglieva invece le bacche e le radici. In ogni caso, dato che i flussi parietali dell’elaborazione spaziale mostrano tratti presenti solo nella nostra specie, sembra abbastanza probabile che le differenze di genere, che vi si osservano, siano comparse dopo la separazione evolutiva tra umani e scimpanzé.
Molte delle differenze di genere identificate nel nostro studio riguardano l’attività delle regioni parietali. Nel genere Homo, lo sviluppo parietale che ha portato alla globularità del cervello è stato descritto dai paleoneurologi come un “pattern moderno”, tipico cioè dell’Homo sapiens (Bruner et al, 2003, 2004). Quindi, nonostante l’Homo neanderthalensis apprezzasse gli oggetti decorativi (Zilhao et al, 2010, ad esempio), sembra che la maniera moderna di reclutare l’attività cerebrale nell’apprezzamento della bellezza sia una caratteristica esclusiva della nostra specie.
Bibliografia
Bruner, E.,
Manzi, G., & Arsuaga, J. L. (2003). Encephalization and allometric
trajectories in the genus Homo:
Evidence from the Neandertal and modern lineages. Proceedings of the National Academy of Sciences, 100, 15335-15340.
Bruner, E.
(2004). Geometric morphometrics and paleoneurology: brain shape evolution in
the genus Homo. Journal of Human
Evolution, 47, 279-303.
Cela-Conde, C.
J., Ayala, F. J., Munar, E., Maestú, F., Nadal, M., Capó, M. A., . . . Marty,
G. (2009). Sex-related similarities and differences in the neural correlates of
beauty. Proceedings of the National
Academy of Sciences, USA, 106, 3847-3852.
Cela-Conde, C. J., Marty, G., Maestú, F., Ortiz, T., Munar, E.,
Fernández, A., . . . Quesney, F. (2004). Activation of the prefrontal cortex in
the human visual aesthetic perception. Proceedings of
the National Academy of Sciences USA, 101,
6321–6325.
Di Dio, C.,
& Gallese, V. (2009). Neuroaesthetics: A review. Current Opinion in Neurobiology, 19, 1-6.
Hyde, J.S.
& Linn, M.C. (1988) Gender differences in verbal ability: A meta-analysis. Psychol Bull, 104, 53–69.
Kawabata, H., & Zeki, S.
(2004). Neural Correlates of Beauty. Journal of Neurophysiology, 91, 1699-1705.
Schirillo, J.
A. (2007). Gender’s effect on the hemispheric laterality of Rembrandt’s
portraits. Spatial Vision, 21(1-2),
19-26.
Silverman, I., & Eals, M. (1992). Sex differences in spatial
abilities: Evolutionary theory and data. In J. Barkow, L. Cosmides & J.
Tooby (Eds.), The Adapted Mind (pp. 487-503). New York, NY: Oxford University
Press.
Van der Ham, I. J. M., Raemaekers, M., Van Wezel, R. J. A., Oleksiak,
A.,& Postma, A. (2009) Categorical and coordinate spatial relations in
working memory: An fMRI study. Brain
Research, 1297, 70-79
Vartanian, O., & Goel, V. (2004). Neuroanatomical correlates of
aesthetic preference for paintings. Neuroreport, 15, 893-897.
Zilhão,
J., Angelucci, D. E., Badal-García, E., d'Errico, F., Daniel, F., Dayet, L., .
. .
Zapata, J. (2010). Symbolic use of marine shells and mineral pigments by
Iberian Neandertals. Proceedings of the
National Academy of Sciences, USA, 107, 1023-1028. doi:
10.1073/pnas.0914088107



