Cellule di grasso. Credit: Ugreen 3S/Shutterstock.
Incredibilmente, proprio nel tessuto adiposo esiste un meccanismo in grado di disperdere l’energia accumulata sotto forma di grassi. Imparare a conoscerlo e a regolarne l’attivazione potrebbe essere una via per correggere alcune patologie metaboliche.
Uno studio su Nature Communications a firma di un gruppo internazionale coordinato da ricercatori dell’Università Statale di Milano, aggiunge nuove e importanti conoscenze sulla fisiologia del tessuto adiposo. Il passaggio dai dati di laboratorio, ottenuti combinando tecnologie d’avanguardia – trascrittomica, proteomica, metabolomica e ingegneria genetica su modelli animali e cellulari – alla sperimentazione clinica fino all’applicazione in specifiche malattie del metabolismo del tessuto adiposo – come obesità e diabete di tipo 2 – è ancora lungo e impegnativo, ma le prospettive sono interessanti.
Tessuto adiposo: partiamo dalle basi
Parlare genericamente di tessuto adiposo è una semplificazione eccessiva che trascura la presenza nell’organismo di due tipi di questo tessuto. Il comune denominatore che li caratterizza è l’accumulo nelle cellule (adipociti) di trigliceridi che fungono da riserva energetica per l’organismo, ma poi le differenze morfologiche e funzionali tra i due tessuti sono rilevanti.

Un’immagine del tessuto adiposo bianco (WAT) caratterizzato da cellule di grandi dimensioni contenenti grosse gocce lipidiche che occupano la maggior parte del citosol in cui i nuclei sono praticamente schiacciati alla periferia della cellula. Credit: "Giovanni Galli” Laboratory.
Quello bianco: un serbatoio cui si ricorre in situazioni in cui l’energia richiesta per le funzioni vitali supera quella prontamente disponibile fornita dagli alimenti, come avviene per esempio durante il digiuno. Quello bruno: una riserva tissutale che contribuisce alla termoregolazione – necessaria per la stabilità della temperatura corporea nei mammiferi – dissipando l’energia accumulata sotto forma di calore, come avviene quando la temperatura dell’ambiente si abbassa.
Gli adipociti dei due tessuti derivano persino da precursori cellulari con origini completamente diverse.
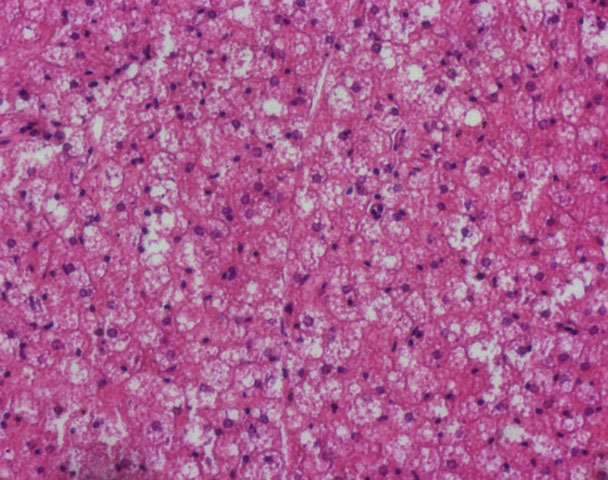
Un’immagine del tessuto adiposo bruno (BAT) caratterizzato da cellule di piccole dimensioni contenenti più gocce lipidiche e di piccole dimensioni (sono quelle goccioline bianche che si vedono in mezzo alla generale colorazione rosa; i nuclei sono quelli con una colorazione più scura. La colorazione è eosina-ematossilina). Credit: "Giovanni Galli” Laboratory.
Su queste nozioni date per acquisite si inseriscono le novità dei dati sperimentali, come spiega Maurizio Crestani, docente di Biochimica e ricercatore senior del Laboratorio “Giovanni Galli” del Dipartimento di Scienze Farmacologiche e Biomolecolari dell’Università Statale di Milano: “Anche nel tessuto adiposo bianco ci sono popolazioni cellulari che, in determinate situazioni (per esempio periodi di adattamento al freddo), vanno incontro a un fenomeno che va sotto il nome di browning e assumono atteggiamenti metabolici che le avvicinano alle cellule del tessuto adiposo bruno. Quando queste sottopopolazioni cellulari del tessuto adiposo bianco subiscono questa riprogrammazione, diventano in grado di dissipare energia termica e partecipare alla termoregolazione”.
Da questa osservazione all’intuizione che il browning si candida come un meccanismo “brucia grassi”, da sfruttare per la correzione di alterazioni del metabolismo del tessuto adiposo, il passo è breve.
Tra freni metabolici e cicli futili
Per comprendere questo potenziale meccanismo “brucia grassi” bisogna fare riferimento a un gruppo di enzimi, le istone deacetilasi (HDAC, histone deacetylase) che controllano la struttura e la funzione del materiale genetico (la cromatina) inducendo una modificazione biochimica degli istoni, le proteine basiche associate al DNA nei cromosomi. “Le deacetilasi interferiscono con diverse vie metaboliche che controllano la fisiologia del tessuto adiposo. Avevamo già osservato in precedenti studi su modelli animali di obesità che l’inibizione di un gruppo di questi enzimi, le istone deacetilasi di classe 1 (tra cui HDAC1, HDAC2 e HDAC3) riprogramma il metabolismo in senso favorevole, inducendo il browning e riducendo la tendenza al sovrappeso e la resistenza all’insulina, due meccanismi alla base dell’insorgenza di diverse malattie metaboliche” spiega il ricercatore “Questa volta la nostra attenzione si è concentrata sulla istone deacetilasi 3 (HDAC3) che, sempre in un modello murino, abbiamo inattivato con tecniche di ingegneria genetica nel tessuto adiposo bianco. Tale manipolazione ha indotto selettivamente il browning e, di conseguenza, una maggiore capacità di disperdere l’energia accumulata sotto forma di grasso in energia termica per effetto dell’aumento del metabolismo ossidativo dei mitocondri”. La istone deacetilasi 3 funge dunque da “freno molecolare” al metabolismo ossidativo e, una volta rimosso il freno, la cellula adiposa del grasso bianco diventa in grado di mettere in atto una termogenesi più spinta. A riprova, i topi portatori dell’inibizione dell’enzima HDAC3 hanno mostrato, dopo esposizione al freddo, una migliore capacità di mantenere la temperatura corporea.
“Abbiamo anche osservato”, prosegue Crestani, “che a seguito dell’inibizione di HDAC3 sono attive nella cellula due vie metaboliche – la sintesi ex novo di lipidi e la beta-ossidazione degli acidi grassi – che, fisiologicamente, sono mutualmente esclusive. Questo fenomeno è riconducibile al disaccoppiamento della catena di trasporto degli elettroni a livello dei mitocondri mediato dalla proteina Ucp1 (Uncoupling protein 1). Si determina così un ciclo futile perché l’adipocita non è capace di produrre energia (ATP) a partire dai grassi e disperde l’energia sotto forma di calore”.
Il passato e il futuro di una linea di ricerca italiana
Lo studio sulle modificazioni molecolari indotte dalle HDAC sulla struttura dell’informazione genetica è una linea di ricerca che al Laboratorio “Giovanni Galli” va avanti da anni con risultati di grande portata per tutta la comunità scientifica. Crestani tiene a sottolineare l’impegno in termini di tempi, risorse umane e tecnologia, nonché la necessità del lavoro in collaborazione: “I dati pubblicati su Nature Communications aggiungono un nuovo importante tassello e sono il frutto di circa 5 anni di sperimentazioni e di un anno e mezzo fra elaborazione e processo editoriale. Abbiamo fatto da capofila a una ricerca internazionale multicentrica dove spiccano il Centro di Genomica Integrata dell’Università di Losanna, il Dipartimento di Biochimica dell’Università Vanderbilt di Nashville e il ProMiFa (Protein Microsequencing Facility) del San Raffaele di Milano. Queste iniziative di collaborazione sono indispensabili per rendere efficaci e rigorosi i progetti sperimentali, che a volte sono scanditi da una vera e propria lotta contro il tempo per giungere a dati conclusivi”. Ancora una volta, nonostante le note e molteplici difficoltà, la ricerca italiana si dimostra competitiva ad alto livello.
Gli studi sul browning esemplificano bene che esperimenti di laboratorio sofisticati su modelli cellulari, combinati agli studi condotti con modelli animali, sono indispensabili e solo apparentemente lontani dalla possibilità di trasferimento al letto del malato, come illustra Crestani: “E’ ragionevole ipotizzare che i prossimi avanzamenti della ricerca possano condurre nel lungo termine ad applicazioni pratiche. Speriamo di individuare interventi terapeutici, per esempio di ingegneria tissutale tramite trapianto di adipociti che abbiano la capacità di andare incontro al browning e dunque di aumentare il turnover dei grassi in pazienti in sovrappeso o obesi. Un altro filone di ricerca è la caratterizzazione del comportamento del tessuto adiposo rispetto al browning in diversi modelli di alterazioni metaboliche dell’uomo. Mi preme evidenziare che la messa a punto di strategie terapeutiche in grado di rimuovere il freno molecolare esercitato da HDCA3 ha ricadute positive non solo per la salute dei singoli pazienti ma anche in termini di sanità pubblica. Basta pensare al peso sulla salute della popolazione mondiale della globesity, la crescita della prevalenza di sovrappeso e obesità così tumultuosa da essere paragonata a un’epidemia che si accompagna allo sviluppo di altre malattie quali il diabete di tipo 2, le malattie cardiovascolari e i tumori”.
Bibliografia:
Ferrari A, Longo R, et al. “HDAC3 is a molecular brake of the metabolic switch supporting white adipose tissue browning”. Nat. Commun. 2017; 8:93.


