
"Open your eyes". Photo by woodleywonderworks - Licenza: CC BY-SA 2.0.
E’ una sera d’estate: il sonno arriva dopo cena, insieme al profumo che le belle di notte esalano solo al buio, per attrarre le farfalle notturne; alle 2 si dorme profondamente, ma verso mattino si sente la necessità di tirare su il lenzuolo, perché sembra faccia più freddo. Alle 8 ci si sveglia e ci si sente sempre più attivi a mano a mano che il giorno procede, fino a che, alle 21, il ciclo ricomincia.
Quando non è sopraffatto dall’attesa di una telefonata, dallo sballo in discoteca o da un turno di notte in fabbrica, il corpo umano, insomma, ha fisiologiche oscillazioni di pressione, di temperatura, di bisogni e di sensazioni, cadenzate sulle diverse fasi della giornata e governate da un preciso gioco di attivazione e spegnimento di geni.
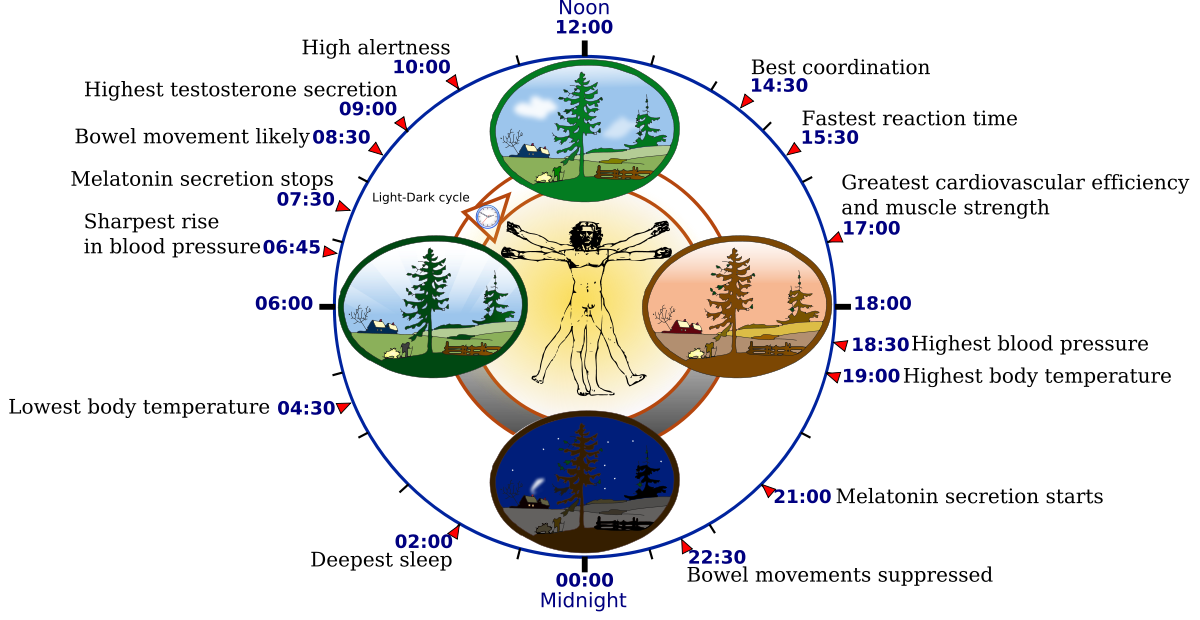
Biological human clock - Created by YassineMrabet. Licenza: CC BY-SA 3.0
Il Nobel ai cacciatori di geni
Si sa che la scienza è, innanzi tutto, curiosità; mentre alcuni scienziati sono curiosi dell’infinitamente grande e inseguono le onde gravitazionali, altri sono curiosi dell’infinitamente piccolo e s’impegnano a scovare i geni responsabili di eventi fisiologici e patologici. A volte, i cacciatori di geni hanno successo, sia pure tardivo: così, il premio Nobel per la Fisiologia o la Medicina 2017 è stato attribuito a tre ricercatori statunitensi settantenni, Jeffrey C. Hall e Michael Rosbash, dell’Università di Boston e Michael W. Young, dell’Università Rockefeller di New York, “per le loro scoperte sui meccanismi molecolari che controllano il ritmo circadiano”, descritte in studi che hanno ottenuto il prestigioso riconoscimento decenni dopo la pubblicazione. Nel 1984, infatti, dieci anni dopo l’intuizione di Seymour Benzer e Ronald Konopka sulla sua esistenza, Hall, Rosbash e Young riuscirono a isolare un gene che regola i ritmi circadiani del moscerino della frutta (Drosophila melanogaster) e lo chiamarono “period”.
Il gene codifica per una proteina (denominata PER) che si accumula nelle cellule durante la notte e viene degradata durante il giorno e che, con un meccanismo di feed-back, va a bloccare il gene stesso. Per poterlo fare è necessario che la proteina PER, prodotta nel citoplasma, entri nel nucleo: ciò è reso possibile dal suo legame con una seconda proteina, denominata TIM, perché codificata dal gene chiamato “timeless”. Infine, un’altra proteina, denominata DBT codificata da un terzo gene (detto “doubletime”), aggiusta l’interazione tra i primi due geni su un periodo di 24 ore. Insieme, queste tre proteine costituiscono gli ingranaggi dell’orologio biologico.

Premio Nobel per la Fisiologia o la Medicina 2017: Jeffrey C. Hall e Michael Rosbash, dell’Università di Boston e Michael W. Young, dell’Università Rockefeller di New York.
Ma a cosa serve un orologio biologico? Sostanzialmente, a far fluire la vita in adattamento alla rotazione del pianeta intorno al suo asse, con un processo definito “sincronizzazione”: quando si svilupparono sulla Terra le varie forme di vita, infatti, quelle in grado di comportarsi secondo le informazioni ricevute dall’ambiente circostante furono avvantaggiate nella sopravvivenza.
Gli orologi biologici
Esistono diversi tipi di ritmi generati dagli orologi biologici interni e tutti sono sincronizzati con i cicli geofisici, per favorire l'adattamento degli organismi alle condizioni fisico-chimiche del loro habitat: il ritmo circadiano (l’aggettivo, coniato da Franz Halberg, deriva dal latino circa diem che significa “intorno a un giorno”) è caratterizzato da un periodo di circa 24 ore; ritmi con periodicità inferiore alle 24 ore vengono detti infradiani e ritmi con periodicità superiore alle 24 ore vengono detti ultradiani.
Alcuni organismi marini (come Eurydice pulchra, un piccolissimo crostaceo studiato dall’Università di Leicester) hanno un ritmo che viene chiamato “circatidale”, perché è sincronizzato con la marea (tide, in inglese), la quale è determinata dall'attrazione gravitazionale che la luna esercita sulla terra ogni 12,4 ore. E la luna influenza anche organismi ben più complessi del pidocchio di mare: secondo gli studi della medicina evoluzionistica, persino il ciclo mestruale delle femmine del genere umano è sincronizzato dal ciclo lunare.
Anche la rivoluzione della Terra attorno al Sole determina variazioni climatiche periodiche (le stagioni): a esse si adatta l’istinto migratorio di molti uccelli e la fertilità di molti animali, cadenzata sul periodo più propizio perché i nuovi nati sopravvivano.
La luce è il più importante Zeitgeber
In cronobiologia, i fattori in grado di sincronizzare l’orologio biologico interno di tutti gli organismi, uomo incluso, con l’ambiente esterno in un ritmo circadiano vengono definiti dalla parola tedesca Zeitgeber (che significa “che dà il tempo” e che equivale alla parola inglese pace-maker). Il più importante Zeitgeber è la luce, che apporta sia le informazioni ambientali su cui variare il comportamento sia l’energia necessaria alla maggior parte delle reazioni biochimiche.
Nell’essere umano, sul ritmo luce-buio, giorno-notte, è regolata l’increzione ormonale, che, a sua volta, governa molteplici funzioni, come il sonno, la temperatura corporea, il metabolismo e il comportamento sociale. Il disallineamento tra la situazione ambientale e l’orologio biologico interno può comportare disagi temporanei, (esemplificati nella sindrome da jet lag dei viaggiatori occasionali), ma anche disturbi cronici, di tipo cognitivo o endocrino, come avviene al personale dei voli transmeridianici e ai lavoratori turnisti.
I ritmi circadiani possono persistere anche in assenza dell’alternanza del giorno e della notte, ma non indefinitamente: in condizioni sperimentali su volontari umani isolati in grotte senza stimoli esterni, si è visto, infatti, un allungamento progressivo del ritmo sonno-veglia, sino ad arrivare a “giorni” di 36 ore.
Inoltre, è nota una mutazione autosomica dominante nel gene period, per cui la proteina PER, per cui esso codifica, non è in grado di esercitare un efficace feed-back sul gene stesso, dando luogo a una sindrome familiare che anticipa al tardo pomeriggio l'esigenza del sonno e induce il risveglio in piena notte.
Ma in che modo la luce esercita il suo influsso sui ritmi fisiologici?
Come funziona la regolazione ormonale
Nell’occhio umano, la luce colpisce i fotorecettori della retina generando impulsi nervosi che raggiungono, lungo le vie ottiche, la corteccia cerebrale (per realizzare la visione) e, con un tragitto chiamato retino-ipotalamico, i nuclei soprachiasmatici dell’ipotalamo. Questa struttura del sistema nervoso centrale, situata in mezzo ai due emisferi cerebrali, svolge un ruolo primario in qualità di orologio circadiano centrale: regola, infatti, la produzione di melatonina da parte dell’epifisi, una ghiandola endocrina situata al centro della scatola cranica, a partire dalla conversione dell’amminoacido triptofano a serotonina. La secrezione di melatonina è stimolata dal buio e inibita dalla luce e cambia anche in relazione ai mutamenti del campo magnetico terrestre; l’ormone, il cui picco in circolo è tra le 2 e le 4 del mattino, induce il sonno e il calo della temperatura corporea.
La melatonina, poi, influenza altri ormoni ed è un potente antiossidante, distruggendo i radicali liberi che danneggiano le cellule. Già dopo la pubertà, però, inizia un processo di calcificazione della ghiandola che prosegue con l’avanzare dell’età, con progressivo calo dell’efficacia endocrina, dimostrato, tra l’altro, dalla difficoltà delle persone anziane ad avere un sonno di buona qualità.

Il nucleo soprachiasmatico dell’ipotalamo controlla anche la produzione surrenalica di cortisolo, chiamato “ormone dello stress” perché mette l’organismo in condizioni di fare fronte a situazioni estreme: fornisce energie supplementari mobilitando le riserve di glucosio immagazzinate nel fegato, riduce le reazioni infiammatorie e induce vasocostrizione per migliorare la distribuzione dell’ossigeno per via ematica. Tutte queste funzioni, tuttavia, si trasformano in danni per l’organismo (diabete, depressione immunitaria e ipertensione) se la produzione di cortisolo è eccedente. In condizioni normali, essa è regolata da un meccanismo di feed-back che coinvolge l’asse ipotalamo-ipofisi-surrene: quando la concentrazione di cortisolo diminuisce, l’ipotalamo invia all’ipofisi l’ormone di rilascio della corticotropina (corticotropin-releasing hormone, CRH), per stimolarla a produrre ACTH (ormone adrenocorticotropo) che, a sua volta, stimola le ghiandole surrenali a produrre cortisolo. La concentrazione di cortisolo nel sangue raggiunge il picco massimo al mattino presto, per poi decrescere durante il giorno, raggiungendo il punto più basso intorno a mezzanotte.
La regolazione ormonale è sottoposta all’orologio biologico sia sotto il profilo della produzione sia sotto quello della sensibilità (e, quindi della risposta) degli organi bersaglio.
Gli orologi periferici
Oltre all’orologio centrale, situato nel nucleo soprachiasmatico dell’ipotalamo, determinano ritmi circadiani di funzione e di comportamento anche orologi periferici, situati nel fegato, nei muscoli e in molti organi e particolari orologi il cui sito anatomico è tuttora sconosciuto. Uno di questi è il food-entrainable oscillator (FEO) in cui è la disponibilità di cibo a fungere da stimolo sincronizzatore (con il coinvolgimento di ormoni quali grelina, leptina, insulina, glucagone e GLP-1). E’, infine, di grande interesse l’osservazione che in ratti desincronizzati, perché tenuti sempre sotto intensa illuminazione, l’assunzione continuativa di basse dosi di metamfetamina ripristina il ritmo circadiano (methamphetamine-sensitive circadian oscillator, MASCO). La scoperta di questo tipo di oscillatore rivela come l’uomo, attraverso l'abuso di sostanze voluttuarie, sia in grado di sovvertire, pagandone il prezzo, una regolazione endocrino-metabolica collaudata in milioni di anni.
Bibliografia
- Anjum et al. "Light exposure at night and rotating night shift associated with circadian disruption of 6-sulfatoxy melatonin". Int J Med Res Health Sci 2013; 2: 809-815.
- Bargiello TA, Jackson FR, Young MW. "Restoration of circadian behavioural rhythms by gene transfer in Drosophila". Nature 1984; 312: 752-4.
- Hall JC. "Genetics and molecular biology of rhythms in Drosophila and other insects". Adv Genet 2003; 48: 1-280.
- Konopka RJ, Benzer S. "Clock mutants of Drosophila melanogaster". Proc Natl Acad Sci USA. 1971 Sep; 68: 2112-16.
- Pendergast JS et al. "Period determination in the food-entrainable and methamphetamine-sensitive circadian oscillator(s)". Proc Natl Acad Sci USA 2012; 109: 14218-14223.
- Reddy P, Zehring WA, Wheeler DA, Pirrotta V, Hadfield C, Hall JC, Rosbash M. "Molecular analysis of the period locus in Drosophila melanogaster and identification of a transcript involved in biological rhythms". Cell 1984; 38: 701-10


